Номер 1, страница 88 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 1. Неметаллы. Параграф 18. Азотная кислота и её соли - номер 1, страница 88.
№1 (с. 88)
Условие. №1 (с. 88)
скриншот условия
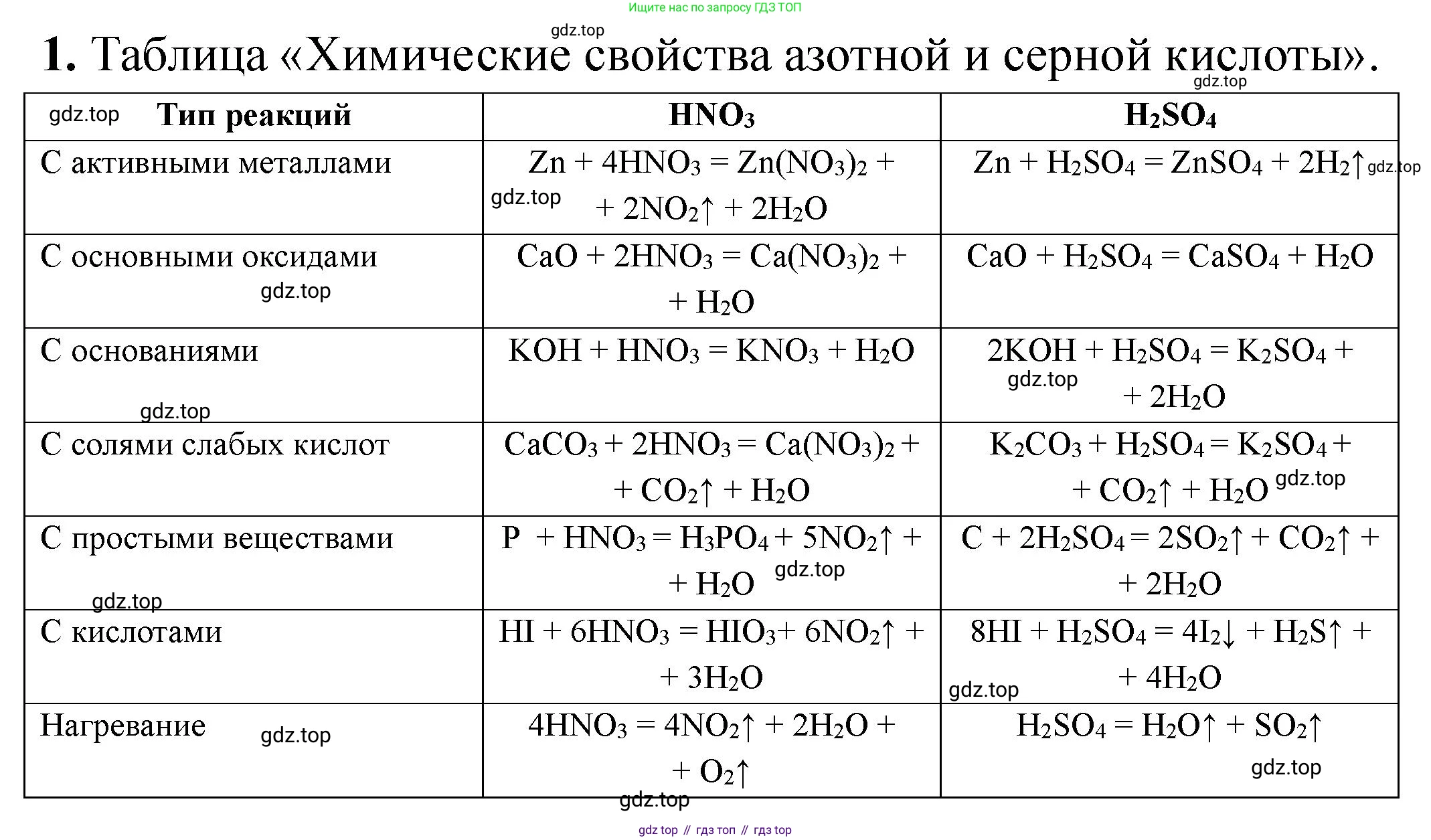
1. Сопоставьте химические свойства азотной и серной кислот.
Решение. №1 (с. 88)
Решение 2. №1 (с. 88)
1. Азотная ($HNO_3$) и серная ($H_2SO_4$) кислоты являются сильными неорганическими кислотами, однако между их химическими свойствами существуют как сходства, так и существенные различия.
Общие свойства (сходства)
Сильные кислоты: Обе кислоты в водных растворах практически полностью диссоциируют на ионы, что обуславливает их высокую кислотность.
$HNO_3 \leftrightarrow H^+ + NO_3^-$
$H_2SO_4 \leftrightarrow H^+ + HSO_4^-$ (первая ступень)Типичные кислотные свойства: Обе кислоты (особенно в разбавленном виде) проявляют свойства, характерные для всех кислот:
Реагируют с основаниями (реакция нейтрализации):
$2HNO_3 + Cu(OH)_2 \rightarrow Cu(NO_3)_2 + 2H_2O$
$H_2SO_4 + 2NaOH \rightarrow Na_2SO_4 + 2H_2O$Реагируют с основными оксидами:
$2HNO_3 + MgO \rightarrow Mg(NO_3)_2 + H_2O$
$H_2SO_4 + CuO \rightarrow CuSO_4 + H_2O$Реагируют с солями более слабых или летучих кислот (например, с карбонатами):
$2HNO_3 + CaCO_3 \rightarrow Ca(NO_3)_2 + H_2O + CO_2\uparrow$
$H_2SO_4 + K_2CO_3 \rightarrow K_2SO_4 + H_2O + CO_2\uparrow$
Отличительные свойства
Основность кислоты:
Азотная кислота ($HNO_3$) — одноосновная. Она имеет один атом водорода, способный замещаться на металл, и образует только один ряд солей — нитраты.
Серная кислота ($H_2SO_4$) — двухосновная. Она имеет два атома водорода и диссоциирует ступенчато. Образует два ряда солей: средние (сульфаты) и кислые (гидросульфаты).
$H_2SO_4 + NaOH \rightarrow NaHSO_4 + H_2O$ (гидросульфат натрия)
$H_2SO_4 + 2NaOH \rightarrow Na_2SO_4 + 2H_2O$ (сульфат натрия)
Окислительные свойства (ключевое различие):
Азотная кислота ($HNO_3$) является сильным окислителем при любой концентрации за счет атома азота в высшей степени окисления +5 ($N^{+5}$). При взаимодействии с металлами она практически никогда не выделяет водород. Продукт восстановления азота зависит от концентрации кислоты и активности металла.
Концентрированная: $Cu + 4HNO_{3(конц)} \rightarrow Cu(NO_3)_2 + 2NO_2\uparrow + 2H_2O$ (выделяется бурый газ $NO_2$)
Разбавленная: $3Cu + 8HNO_{3(разб)} \rightarrow 3Cu(NO_3)_2 + 2NO\uparrow + 4H_2O$ (выделяется бесцветный газ $NO$)
Очень разбавленная (с активными металлами): $4Zn + 10HNO_{3(оч. разб)} \rightarrow 4Zn(NO_3)_2 + NH_4NO_3 + 3H_2O$ (азот восстанавливается до -3)Серная кислота ($H_2SO_4$) проявляет окислительные свойства по-разному в зависимости от концентрации.
Разбавленная: Ведет себя как обычная кислота. Окислителем является ион водорода ($H^+$). Реагирует с металлами, стоящими в ряду активности до водорода, с выделением $H_2$.
$Zn + H_2SO_{4(разб)} \rightarrow ZnSO_4 + H_2\uparrow$
Концентрированная: Является сильным окислителем за счет серы в степени окисления +6 ($S^{+6}$). Реагирует с большинством металлов (в том числе с малоактивными, стоящими после водорода), но водород при этом не выделяется. Продукт восстановления серы зависит от активности металла.
$Cu + 2H_2SO_{4(конц)} \xrightarrow{t} CuSO_4 + SO_2\uparrow + 2H_2O$ (с малоактивным металлом)
$3Zn + 4H_2SO_{4(конц)} \xrightarrow{t} 3ZnSO_4 + S\downarrow + 4H_2O$ (с металлом средней активности)
$4Mg + 5H_2SO_{4(конц)} \rightarrow 4MgSO_4 + H_2S\uparrow + 4H_2O$ (с активным металлом)Пассивация: Обе кислоты в концентрированном виде на холоде пассивируют некоторые металлы (например, железо $Fe$, алюминий $Al$, хром $Cr$), образуя на их поверхности плотную оксидную пленку, которая препятствует дальнейшей реакции.
Термическая устойчивость и летучесть:
Азотная кислота ($HNO_3$) — летучая ($t_{кип} \approx 83^\circ C$) и термически неустойчивая. При хранении на свету или при нагревании разлагается:
$4HNO_3 \xrightarrow{hv, t} 4NO_2\uparrow + O_2\uparrow + 2H_2O$. Образующийся $NO_2$ придает кислоте желтоватый оттенок.Серная кислота ($H_2SO_4$) — нелетучая ($t_{кип} \approx 337^\circ C$) и термически более устойчивая. Это свойство позволяет ей вытеснять летучие кислоты (включая азотную) из их солей при нагревании:
$2NaNO_3 + H_2SO_{4(конц)} \xrightarrow{t} Na_2SO_4 + 2HNO_3\uparrow$
Специфические свойства:
Концентрированная серная кислота — сильное водоотнимающее средство. Она способна отнимать воду у органических веществ (например, сахарозы), обугливая их:
$C_{12}H_{22}O_{11} \xrightarrow{H_2SO_4 (конц.)} 12C + 11H_2O$Азотная кислота — нитрующий агент. Она вступает в реакции нитрования с органическими соединениями, например, с бензолом (в присутствии $H_2SO_4$ как катализатора и водоотнимающего средства):
$C_6H_6 + HNO_3 \xrightarrow{H_2SO_4} C_6H_5NO_2 + H_2O$
Ответ:
Азотная и серная кислоты являются сильными минеральными кислотами, проявляющими общие кислотные свойства (реакции с основаниями, основными оксидами, солями летучих кислот). Однако они имеют существенные различия. Серная кислота — двухосновная, нелетучая и термически устойчивая; разбавленная $H_2SO_4$ реагирует с металлами до $H_2$ с выделением водорода, а концентрированная является сильным окислителем за счет $S^{+6}$ и водоотнимающим средством. Азотная кислота — одноосновная, летучая и термически неустойчивая; она является сильным окислителем при любой концентрации за счет $N^{+5}$, практически никогда не выделяя водород при реакции с металлами, а продуктами ее восстановления могут быть различные оксиды азота, азот или аммиак (в виде соли). Также $HNO_3$ является нитрующим агентом для органических соединений.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 1 расположенного на странице 88 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 88), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















