Номер 8, страница 89 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 1. Неметаллы. Параграф 18. Азотная кислота и её соли - номер 8, страница 89.
№8 (с. 89)
Условие. №8 (с. 89)
скриншот условия

8. Нитрит натрия в лаборатории получают восстановлением нитрата сернистым газом. Сколько граммов серы необходимо сжечь для получения 6,9 г нитрита, если сернистый газ для восстановления берут в десятикратном избытке?
Решение. №8 (с. 89)
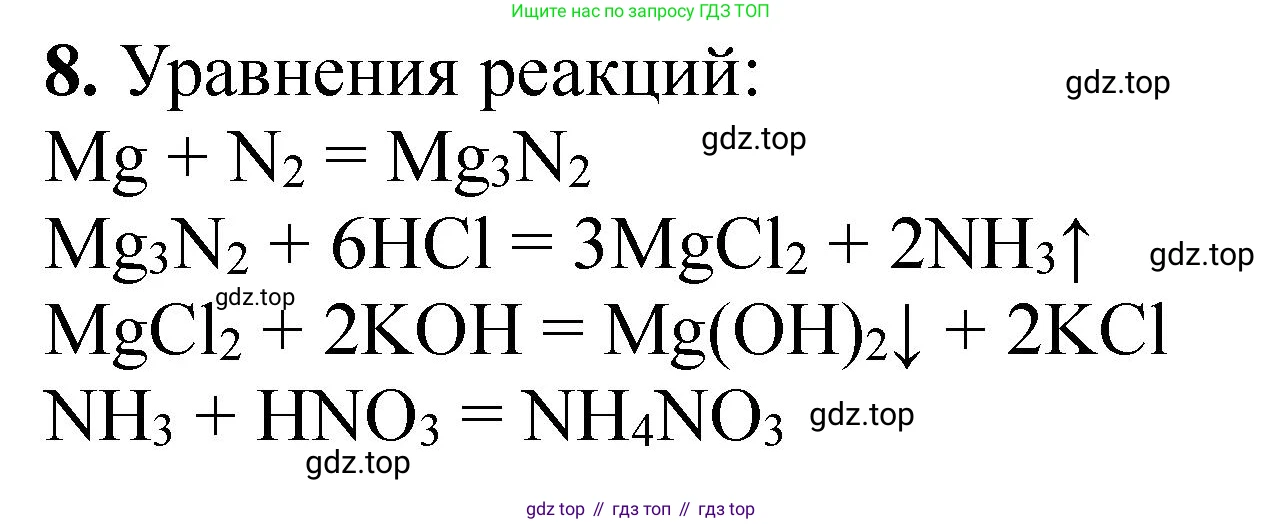
Решение 2. №8 (с. 89)
Дано:
$m(NaNO_2) = 6.9$ г
Сернистый газ ($SO_2$) взят в 10-кратном избытке.
Найти:
$m(S)$ — ?
Решение:
1. Запишем уравнения химических реакций, протекающих в процессе.
Сначала серу сжигают для получения сернистого газа (диоксида серы):
(1) $S + O_2 \rightarrow SO_2$
Затем сернистым газом восстанавливают нитрат натрия до нитрита натрия. Эта реакция является окислительно-восстановительной, где азот в нитрате восстанавливается с $N^{+5}$ до $N^{+3}$, а сера в диоксиде серы окисляется с $S^{+4}$ до $S^{+6}$. Чтобы продукты были стабильными, реакцию обычно проводят в щелочной среде (например, с $NaOH$ или $Na_2CO_3$), чтобы образовавшийся $SO_3$ (или соответствующая ему серная кислота) был нейтрализован. Уравнение реакции с гидроксидом натрия выглядит так:
(2) $2NaNO_3 + SO_2 + 2NaOH \rightarrow 2NaNO_2 + Na_2SO_4 + H_2O$
Из стехиометрии этого уравнения следует, что на 1 моль прореагировавшего $SO_2$ образуется 2 моль $NaNO_2$.
2. Рассчитаем молярную массу и количество вещества полученного нитрита натрия ($NaNO_2$).
Молярная масса $NaNO_2$:
$M(NaNO_2) = 23 + 14 + 2 \cdot 16 = 69$ г/моль.
Количество вещества $NaNO_2$:
$n(NaNO_2) = \frac{m(NaNO_2)}{M(NaNO_2)} = \frac{6.9 \text{ г}}{69 \text{ г/моль}} = 0.1$ моль.
3. Определим количество вещества $SO_2$, которое вступило в реакцию для получения 0.1 моль $NaNO_2$.
Согласно уравнению (2), $n(SO_2) : n(NaNO_2) = 1 : 2$.
$n_{реаг.}(SO_2) = \frac{1}{2} n(NaNO_2) = \frac{1}{2} \cdot 0.1 \text{ моль} = 0.05$ моль.
4. Рассчитаем общее количество вещества $SO_2$, которое было взято для реакции, с учётом десятикратного избытка.
$n_{общ.}(SO_2) = 10 \cdot n_{реаг.}(SO_2) = 10 \cdot 0.05 \text{ моль} = 0.5$ моль.
5. Определим количество вещества серы (S), необходимое для получения 0.5 моль $SO_2$.
Согласно уравнению (1), $n(S) : n(SO_2) = 1 : 1$.
$n(S) = n_{общ.}(SO_2) = 0.5$ моль.
6. Рассчитаем массу серы.
Молярная масса серы $M(S) = 32$ г/моль.
$m(S) = n(S) \cdot M(S) = 0.5 \text{ моль} \cdot 32 \text{ г/моль} = 16$ г.
Ответ: необходимо сжечь 16 г серы.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 8 расположенного на странице 89 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №8 (с. 89), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















