Номер 6, страница 89 - гдз по химии 11 класс учебник Еремин, Кузьменко

Авторы: Еремин В. В., Кузьменко Н. Е., Дроздов А. А., Лунин В. В.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: углублённый
Цвет обложки: белый, зелёный с кораллом
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 11 классе
Глава 1. Неметаллы. Параграф 18. Азотная кислота и её соли - номер 6, страница 89.
№6 (с. 89)
Условие. №6 (с. 89)
скриншот условия
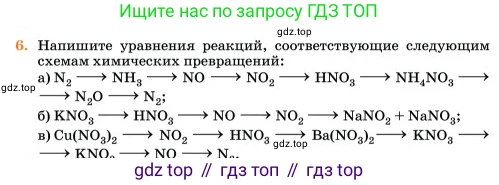
6. Напишите уравнения реакций, соответствующие следующим схемам химических превращений:
a) $N_2$ $\rightarrow$ $NH_3$ $\rightarrow$ $NO$ $\rightarrow$ $NO_2$ $\rightarrow$ $HNO_3$ $\rightarrow$ $NH_4NO_3$ $\rightarrow$ $N_2O$ $\rightarrow$ $N_2$;
б) $KNO_3$ $\rightarrow$ $HNO_3$ $\rightarrow$ $NO$ $\rightarrow$ $NO_2$ $\rightarrow$ $NaNO_2$ + $NaNO_3$;
в) $Cu(NO_3)_2$ $\rightarrow$ $NO_2$ $\rightarrow$ $HNO_3$ $\rightarrow$ $Ba(NO_3)_2$ $\rightarrow$ $KNO_3$ $\rightarrow$ $KNO_3$ $\rightarrow$ $NO$ $\rightarrow$ $N_2$;
Решение. №6 (с. 89)

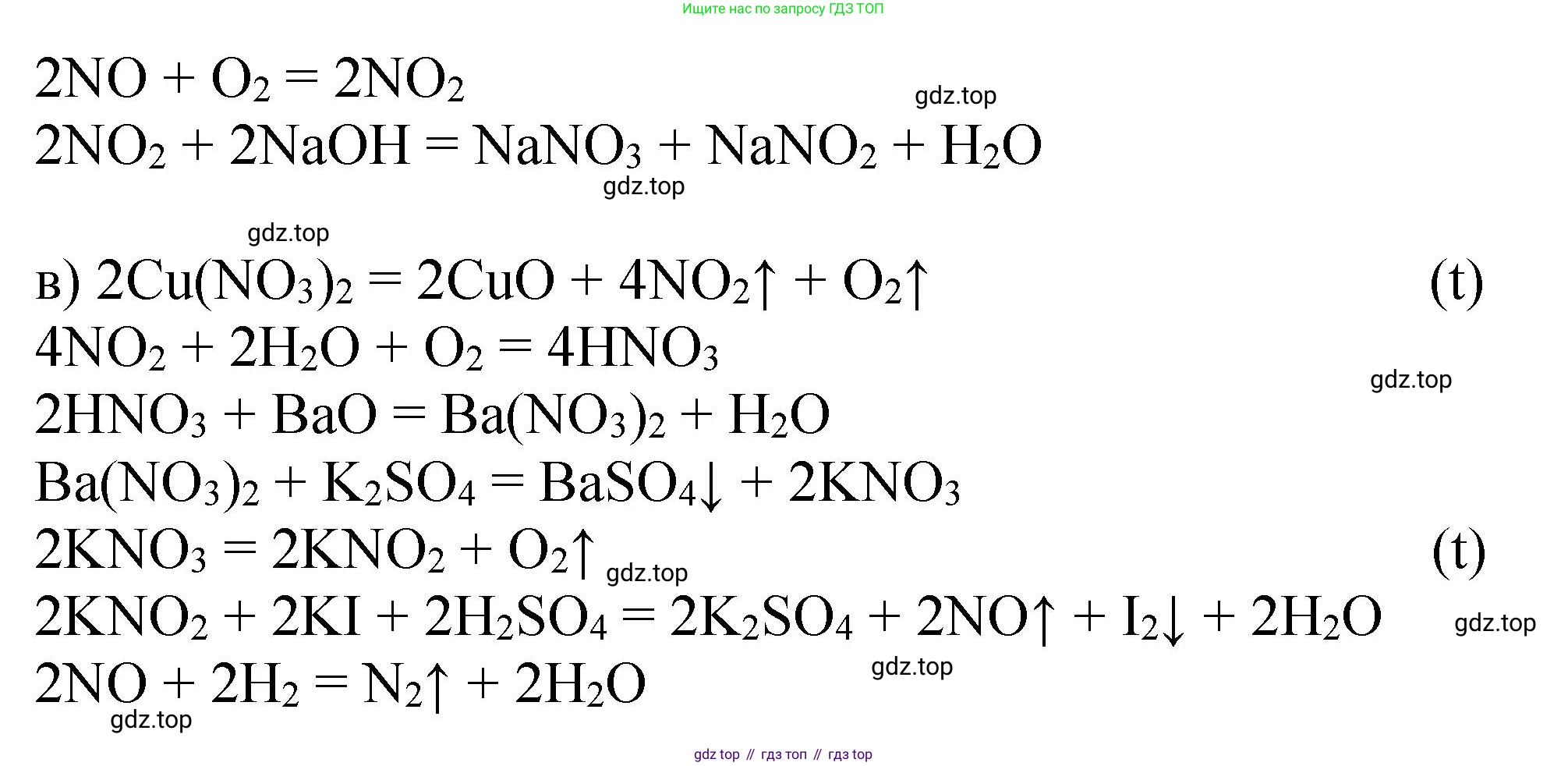
Решение 2. №6 (с. 89)
Ниже приведены уравнения реакций для каждой из трех схем химических превращений.
а) $N_2 \rightarrow NH_3 \rightarrow NO \rightarrow NO_2 \rightarrow HNO_3 \rightarrow NH_4NO_3 \rightarrow N_2O \rightarrow N_2$1. Синтез аммиака из азота и водорода (процесс Габера-Боша). Реакция обратима, протекает при высоком давлении, температуре и в присутствии катализатора (например, железа).
$N_2 + 3H_2 \rightleftharpoons 2NH_3$
2. Каталитическое окисление аммиака кислородом на платино-родиевом катализаторе при высокой температуре. Это первая стадия промышленного получения азотной кислоты.
$4NH_3 + 5O_2 \xrightarrow{Pt, t} 4NO + 6H_2O$
3. Окисление оксида азота(II) кислородом воздуха до оксида азота(IV). Реакция протекает самопроизвольно при обычных условиях.
$2NO + O_2 \rightarrow 2NO_2$
4. Получение азотной кислоты путём поглощения оксида азота(IV) водой в присутствии кислорода.
$4NO_2 + O_2 + 2H_2O \rightarrow 4HNO_3$
5. Реакция нейтрализации: взаимодействие азотной кислоты с газообразным аммиаком или его водным раствором с образованием нитрата аммония.
$HNO_3 + NH_3 \rightarrow NH_4NO_3$
6. Термическое разложение нитрата аммония при осторожном нагревании (примерно 190-245 °C).
$NH_4NO_3 \xrightarrow{t} N_2O + 2H_2O$
7. Термическое разложение оксида азота(I) на простые вещества при сильном нагревании (выше 500 °C) или его восстановление, например, над раскаленной медью.
$2N_2O \xrightarrow{t} 2N_2 + O_2$
Ответ:
1. $N_2 + 3H_2 \rightleftharpoons 2NH_3$
2. $4NH_3 + 5O_2 \xrightarrow{Pt, t} 4NO + 6H_2O$
3. $2NO + O_2 \rightarrow 2NO_2$
4. $4NO_2 + O_2 + 2H_2O \rightarrow 4HNO_3$
5. $HNO_3 + NH_3 \rightarrow NH_4NO_3$
6. $NH_4NO_3 \xrightarrow{t} N_2O + 2H_2O$
7. $2N_2O \xrightarrow{t} 2N_2 + O_2$
б) $KNO_3 \rightarrow HNO_3 \rightarrow NO \rightarrow NO_2 \rightarrow NaNO_2 + NaNO_3$1. Лабораторный способ получения азотной кислоты: вытеснение летучей азотной кислоты из её соли (нитрата калия) менее летучей концентрированной серной кислотой при нагревании.
$KNO_3(тв.) + H_2SO_4(конц.) \xrightarrow{t} KHSO_4 + HNO_3$
2. Восстановление разбавленной азотной кислоты медью. В результате реакции образуется соль меди(II), оксид азота(II) и вода.
$3Cu + 8HNO_3(разб.) \rightarrow 3Cu(NO_3)_2 + 2NO + 4H_2O$
3. Окисление оксида азота(II) кислородом воздуха до оксида азота(IV).
$2NO + O_2 \rightarrow 2NO_2$
4. Взаимодействие оксида азота(IV) с раствором щёлочи (например, гидроксида натрия). Это реакция диспропорционирования, в которой образуются две соли: нитрит натрия и нитрат натрия.
$2NO_2 + 2NaOH \rightarrow NaNO_2 + NaNO_3 + H_2O$
Ответ:
1. $KNO_3 + H_2SO_4 \xrightarrow{t} KHSO_4 + HNO_3$
2. $3Cu + 8HNO_3(разб.) \rightarrow 3Cu(NO_3)_2 + 2NO + 4H_2O$
3. $2NO + O_2 \rightarrow 2NO_2$
4. $2NO_2 + 2NaOH \rightarrow NaNO_2 + NaNO_3 + H_2O$
в) $Cu(NO_3)_2 \rightarrow NO_2 \rightarrow HNO_3 \rightarrow Ba(NO_3)_2 \rightarrow KNO_3 \rightarrow KNO_2 \rightarrow NO \rightarrow N_2$1. Термическое разложение нитрата меди(II) при нагревании. Нитраты металлов средней активности разлагаются на оксид металла, оксид азота(IV) и кислород.
$2Cu(NO_3)_2 \xrightarrow{t} 2CuO + 4NO_2 + O_2$
2. Получение азотной кислоты из оксида азота(IV), воды и кислорода.
$4NO_2 + O_2 + 2H_2O \rightarrow 4HNO_3$
3. Реакция нейтрализации: взаимодействие азотной кислоты с основанием (гидроксидом бария) с образованием соли (нитрата бария) и воды.
$2HNO_3 + Ba(OH)_2 \rightarrow Ba(NO_3)_2 + 2H_2O$
4. Реакция ионного обмена для получения нитрата калия. При смешивании растворов нитрата бария и сульфата калия в осадок выпадает нерастворимый сульфат бария.
$Ba(NO_3)_2 + K_2SO_4 \rightarrow BaSO_4 \downarrow + 2KNO_3$
5. Термическое разложение нитрата калия. Нитраты щелочных металлов (кроме лития) при нагревании разлагаются до нитритов и кислорода.
$2KNO_3 \xrightarrow{t} 2KNO_2 + O_2$
6. Получение оксида азота(II) из нитрита калия. Например, в реакции с иодидом калия в кислой среде (серная кислота).
$2KNO_2 + 2KI + 2H_2SO_4 \rightarrow 2NO + I_2 + 2K_2SO_4 + 2H_2O$
7. Восстановление оксида азота(II) до свободного азота, например, с помощью аммиака. Эта реакция используется для очистки промышленных газов.
$6NO + 4NH_3 \xrightarrow{кат., t} 5N_2 + 6H_2O$
Ответ:
1. $2Cu(NO_3)_2 \xrightarrow{t} 2CuO + 4NO_2 + O_2$
2. $4NO_2 + O_2 + 2H_2O \rightarrow 4HNO_3$
3. $2HNO_3 + Ba(OH)_2 \rightarrow Ba(NO_3)_2 + 2H_2O$
4. $Ba(NO_3)_2 + K_2SO_4 \rightarrow BaSO_4 \downarrow + 2KNO_3$
5. $2KNO_3 \xrightarrow{t} 2KNO_2 + O_2$
6. $2KNO_2 + 2KI + 2H_2SO_4 \rightarrow 2NO + I_2 + 2K_2SO_4 + 2H_2O$
7. $6NO + 4NH_3 \xrightarrow{кат., t} 5N_2 + 6H_2O$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 11 класс, для упражнения номер 6 расположенного на странице 89 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6 (с. 89), авторов: Еремин (Вадим Владимирович), Кузьменко (Николай Егорович), Дроздов (Андрей Анатольевич), Лунин (Валерий Васильевич), ФГОС (старый) углублённый уровень обучения учебного пособия издательства Просвещение.

















