Номер 3, страница 92 - гдз по химии 8 класс учебник Габриелян

Авторы: Габриелян О. С.
Тип: Учебник
Издательство: Просвещение
Год издания: 2021 - 2025
Цвет обложки: белый
ISBN: 978-5-09-105083-7
Популярные ГДЗ в 8 классе
Глава 2. Простые вещества. Параграф 15. Простые вещества — неметаллы - номер 3, страница 92.
№3 (с. 92)
Условие. №3 (с. 92)

Решение. №3 (с. 92)
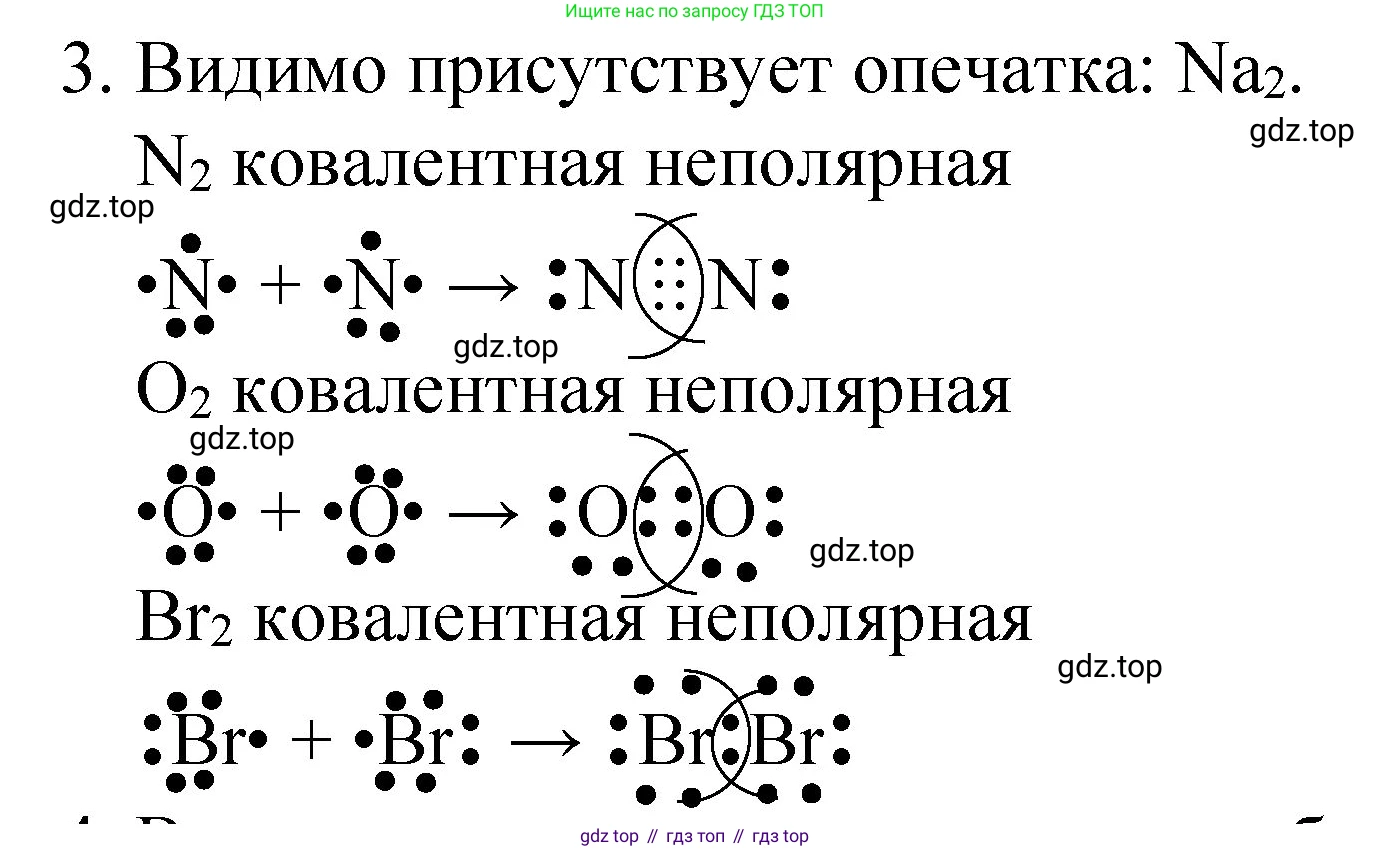
Решение 2. №3 (с. 92)
Решение
Na₂
Атом натрия ($_{11}Na$) — щелочной металл, его электронная конфигурация $1s^2 2s^2 2p^6 3s^1$. На внешнем (валентном) энергетическом уровне находится один электрон. При образовании двухатомной молекулы $Na_2$ (которая существует в газовой фазе, в парах натрия) два атома натрия обобществляют свои валентные электроны, образуя одну общую электронную пару.
Схема образования связи (с использованием электронных точек Льюиса):
$Na \cdot + \cdot Na \rightarrow Na:Na$ (или $Na-Na$)
Так как связь образована между атомами одного и того же элемента, общая электронная пара не смещается, и связь является ковалентной неполярной.
Ответ: В молекуле $Na_2$ химическая связь ковалентная неполярная, одинарная.
Br₂
Атом брома ($_{35}Br$) — галоген, находится в 17-й группе (VIIA). Его электронная конфигурация валентного слоя $...4s^2 4p^5$. На внешнем уровне у него 7 валентных электронов (три электронные пары и один неспаренный электрон). До завершения внешнего уровня (достижения октета) атому брома не хватает одного электрона.
При образовании молекулы $Br_2$ каждый из двух атомов брома предоставляет по одному неспаренному электрону для создания общей электронной пары.
Схема образования связи:
$:\ddot{Br}\cdot + \cdot\ddot{Br}: \rightarrow :\ddot{Br}:\ddot{Br}:$ (или $Br-Br$)
В результате образуется одна общая электронная пара (одинарная связь), и каждый атом брома приобретает завершенную электронную оболочку из 8 электронов.
Ответ: В молекуле $Br_2$ химическая связь ковалентная неполярная, одинарная.
O₂
Атом кислорода ($_{8}O$) находится в 16-й группе (VIA). Его электронная конфигурация $1s^2 2s^2 2p^4$. На внешнем уровне у него 6 валентных электронов (две электронные пары и два неспаренных электрона). До завершения октета атому кислорода не хватает двух электронов.
При образовании молекулы $O_2$ каждый из двух атомов кислорода предоставляет по два неспаренных электрона для создания двух общих электронных пар.
Схема образования связи:
$\cdot\ddot{O}\cdot + \cdot\ddot{O}\cdot \rightarrow \ddot{O}::\ddot{O}$ (или $\ddot{O}=\ddot{O}$)
В результате между атомами кислорода образуется двойная связь. Каждый атом кислорода достигает стабильного октета.
Ответ: В молекуле $O_2$ химическая связь ковалентная неполярная, двойная.
N₂
Атом азота ($_{7}N$) находится в 15-й группе (VA). Его электронная конфигурация $1s^2 2s^2 2p^3$. На внешнем уровне у него 5 валентных электронов (одна электронная пара и три неспаренных электрона). До завершения октета атому азота не хватает трех электронов.
При образовании молекулы $N_2$ каждый из двух атомов азота предоставляет по три неспаренных электрона для создания трех общих электронных пар.
Схема образования связи:
$\cdot\dot{N}\cdot + \cdot\dot{N}\cdot \rightarrow :N:::N:$ (или $:N \equiv N:$)
В результате между атомами азота образуется тройная связь, которая является очень прочной. Каждый атом азота достигает стабильного октета.
Ответ: В молекуле $N_2$ химическая связь ковалентная неполярная, тройная.
Общий вывод по типу связи:
Во всех представленных молекулах ($Na_2$, $Br_2$, $O_2$, $N_2$) химическая связь образуется между атомами одного и того же химического элемента. Электроотрицательность этих атомов одинакова, следовательно, разность электроотрицательностей равна нулю. Общие электронные пары располагаются симметрично относительно ядер обоих атомов. Такая связь называется ковалентной неполярной.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 3 расположенного на странице 92 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 92), автора: Габриелян (Олег Саргисович), ФГОС (старый) учебного пособия издательства Просвещение.
















