Номер 3, страница 99 - гдз по химии 8 класс учебник Габриелян

Авторы: Габриелян О. С.
Тип: Учебник
Издательство: Просвещение
Год издания: 2021 - 2025
Цвет обложки: белый
ISBN: 978-5-09-105083-7
Популярные ГДЗ в 8 классе
Глава 2. Простые вещества. Параграф 17. Молярный объём газов. Вопросы - номер 3, страница 99.
№3 (с. 99)
Условие. №3 (с. 99)

Решение. №3 (с. 99)
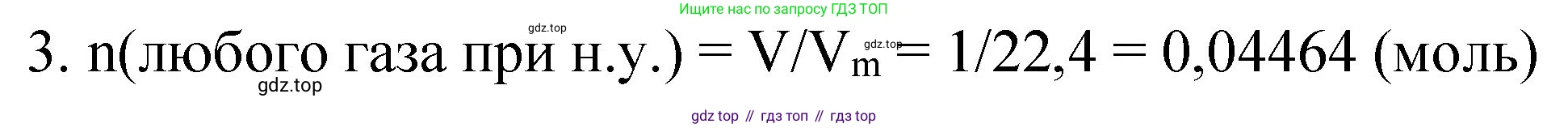

Решение 2. №3 (с. 99)
Дано:
Газы: аргон (Ar), хлор (Cl₂), кислород (O₂), озон (O₃)
Условия: нормальные (н. у.)
Объем каждого газа, $V = 1$ л
Перевод данных в систему СИ:
Нормальные условия (н. у.) соответствуют:
Температура: $T = 0 \text{ °C} = 273.15 \text{ К}$
Давление: $P = 1 \text{ атм} = 101325 \text{ Па}$
Объем: $V = 1 \text{ л} = 1 \text{ дм}^3 = 10^{-3} \text{ м}^3$
Найти:
1. Плотности $\rho$ (массу 1 л) для Ar, Cl₂, O₂, O₃.
2. Число молекул $N$ в 1 л для каждого из веществ.
Решение:
Найдите плотности (массу 1 л) аргона, хлора, кислорода и озона при н. у.
Плотность газа ($\rho$) при нормальных условиях можно рассчитать, зная его молярную массу ($M$) и молярный объем газов при н. у. ($V_m = 22.4$ л/моль). Формула для расчета:
$\rho = \frac{M}{V_m}$
Масса 1 литра газа численно равна его плотности, выраженной в г/л. Сначала найдем молярные массы указанных газов, используя значения относительных атомных масс из Периодической системы химических элементов Д.И. Менделеева (округляя до целых чисел, для хлора до десятых):
- Молярная масса аргона: $M(\text{Ar}) \approx 40$ г/моль.
- Молярная масса хлора: $M(\text{Cl}_2) = 2 \times 35.5 = 71$ г/моль.
- Молярная масса кислорода: $M(\text{O}_2) = 2 \times 16 = 32$ г/моль.
- Молярная масса озона: $M(\text{O}_3) = 3 \times 16 = 48$ г/моль.
Теперь рассчитаем плотности:
Для аргона (Ar):
$\rho(\text{Ar}) = \frac{40 \text{ г/моль}}{22.4 \text{ л/моль}} \approx 1.786 \text{ г/л}$
Для хлора (Cl₂):
$\rho(\text{Cl}_2) = \frac{71 \text{ г/моль}}{22.4 \text{ л/моль}} \approx 3.170 \text{ г/л}$
Для кислорода (O₂):
$\rho(\text{O}_2) = \frac{32 \text{ г/моль}}{22.4 \text{ л/моль}} \approx 1.429 \text{ г/л}$
Для озона (O₃):
$\rho(\text{O}_3) = \frac{48 \text{ г/моль}}{22.4 \text{ л/моль}} \approx 2.143 \text{ г/л}$
Ответ: Плотности (массы 1 л) газов при н. у. составляют: для аргона $\approx 1.786$ г/л, для хлора $\approx 3.170$ г/л, для кислорода $\approx 1.429$ г/л, для озона $\approx 2.143$ г/л.
Сколько молекул каждого вещества будет содержаться в 1 л при тех же условиях?
Согласно закону Авогадро, в равных объемах любых газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул. Поэтому в 1 л каждого из указанных газов при н. у. будет содержаться одинаковое количество молекул.
Для расчета числа молекул ($N$) сначала найдем количество вещества ($n$) в 1 л газа при н. у., используя молярный объем $V_m$:
$n = \frac{V}{V_m} = \frac{1 \text{ л}}{22.4 \text{ л/моль}} \approx 0.04464 \text{ моль}$
Затем, зная количество вещества, найдем число молекул, используя постоянную Авогадро $N_A \approx 6.022 \times 10^{23}$ моль⁻¹:
$N = n \times N_A \approx 0.04464 \text{ моль} \times 6.022 \times 10^{23} \text{ моль}^{-1} \approx 2.688 \times 10^{22}$
Ответ: В 1 л каждого из указанных газов (аргона, хлора, кислорода, озона) при н. у. содержится примерно $2.688 \times 10^{22}$ молекул.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 3 расположенного на странице 99 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 99), автора: Габриелян (Олег Саргисович), ФГОС (старый) учебного пособия издательства Просвещение.
















