Номер 2, страница 252 - гдз по химии 8 класс учебник Габриелян

Авторы: Габриелян О. С.
Тип: Учебник
Издательство: Просвещение
Год издания: 2021 - 2025
Цвет обложки: белый
ISBN: 978-5-09-105083-7
Популярные ГДЗ в 8 классе
Глава 5. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции. Параграф 41. Оксиды, их классификация и свойства - номер 2, страница 252.
№2 (с. 252)
Условие. №2 (с. 252)

Решение. №2 (с. 252)
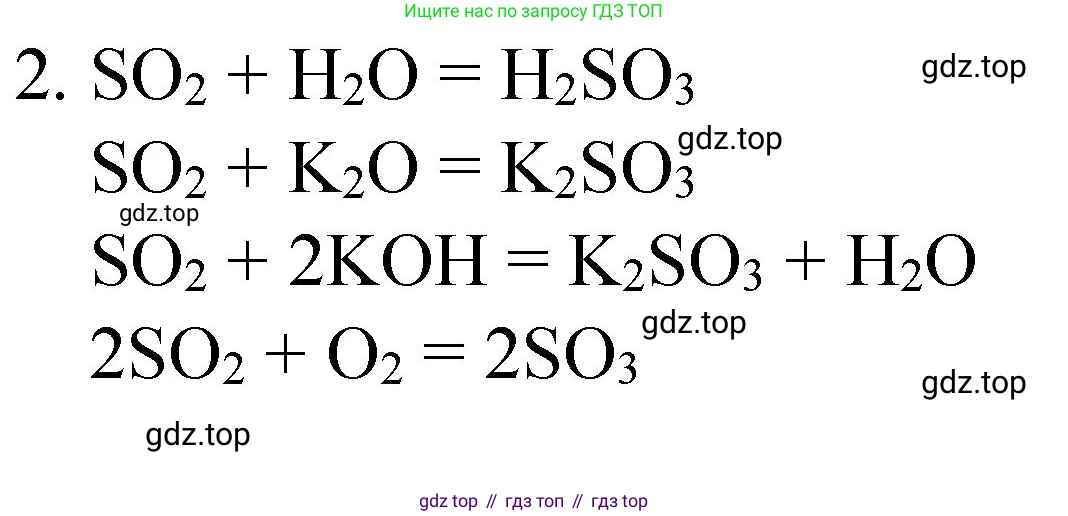
Решение 2. №2 (с. 252)
Решение
Оксид серы (IV), или сернистый газ, химическая формула которого $SO_2$, является типичным кислотным оксидом. В этом соединении сера проявляет степень окисления +4, которая является промежуточной для серы (возможные степени окисления от -2 до +6). Это обуславливает двойственность его окислительно-восстановительных свойств.
1. Кислотные свойства
Как кислотный оксид, $SO_2$ взаимодействует с водой, основными и амфотерными оксидами, а также с основаниями.
а) Взаимодействие с водой:
При растворении в воде оксид серы (IV) обратимо образует слабую двухосновную сернистую кислоту ($H_2SO_3$), которая существует только в растворе.
$SO_2 + H_2O \rightleftharpoons H_2SO_3$
б) Взаимодействие с основными оксидами:
Реагирует с основными оксидами при нагревании, образуя соли сернистой кислоты — сульфиты.
$SO_2 + CaO \rightarrow CaSO_3$ (сульфит кальция)
в) Взаимодействие с основаниями (щелочами):
В зависимости от соотношения реагентов могут образовываться как средние соли (сульфиты), так и кислые (гидросульфиты).
- При избытке щелочи образуется средняя соль и вода:
$SO_2 + 2NaOH \rightarrow Na_2SO_3 + H_2O$ (сульфит натрия)
- При избытке оксида серы (IV) или при их эквимолярном соотношении образуется кислая соль:
$SO_2 + NaOH \rightarrow NaHSO_3$ (гидросульфит натрия)
2. Окислительно-восстановительные свойства
Атом серы в $SO_2$ имеет степень окисления +4, поэтому оксид серы (IV) может быть как восстановителем (повышая степень окисления до +6), так и окислителем (понижая степень окисления до 0 или -2).
а) $SO_2$ как восстановитель (S⁺⁴ → S⁺⁶):
Восстановительные свойства проявляются в реакциях с более сильными окислителями.
- Окисление кислородом воздуха в присутствии катализатора (ключевая стадия производства серной кислоты):
$2\stackrel{+4}{S}O_2 + O_2 \xrightarrow{V_2O_5, 450-500^{\circ}C} 2\stackrel{+6}{S}O_3$
- Взаимодействие с галогенами (например, обесцвечивание бромной воды):
$\stackrel{+4}{S}O_2 + Br_2 + 2H_2O \rightarrow H_2\stackrel{+6}{S}O_4 + 2HBr$
- Реакция с перманганатом калия (раствор обесцвечивается):
$5\stackrel{+4}{S}O_2 + 2K\stackrel{+7}{Mn}O_4 + 2H_2O \rightarrow 2H_2\stackrel{+6}{S}O_4 + 2\stackrel{+2}{Mn}SO_4 + K_2SO_4$
б) $SO_2$ как окислитель (S⁺⁴ → S⁰ или S⁻²):
Окислительные свойства проявляются в реакциях с сильными восстановителями.
- Взаимодействие с сероводородом (реакция сопропорционирования, промышленный способ получения серы по методу Клауса):
$\stackrel{+4}{S}O_2 + 2H_2\stackrel{-2}{S} \rightarrow 3\stackrel{0}{S}\downarrow + 2H_2O$
- Восстановление активными металлами или углем при нагревании:
$\stackrel{+4}{S}O_2 + 2Mg \xrightarrow{t} \stackrel{0}{S} + 2MgO$
Ответ: Оксид серы(IV) ($SO_2$) является типичным кислотным оксидом, которому соответствует слабая сернистая кислота. Из-за промежуточной степени окисления серы +4, он проявляет двойственные окислительно-восстановительные свойства: выступает восстановителем в реакциях с сильными окислителями (например, $O_2, KMnO_4, Br_2$) и окислителем в реакциях с сильными восстановителями (например, $H_2S, Mg$).
Характерные реакции:
1. Кислотные свойства: $SO_2 + 2NaOH \rightarrow Na_2SO_3 + H_2O$
2. Восстановительные свойства: $2SO_2 + O_2 \xrightarrow{кат., t} 2SO_3$
3. Окислительные свойства: $SO_2 + 2H_2S \rightarrow 3S + 2H_2O$
Другие задания:
5
стр. 2476
стр. 247Лабораторный опыт № 27
стр. 249Лабораторный опыт № 28
стр. 250Лабораторный опыт № 29
стр. 251Лабораторный опыт № 30
стр. 2521
стр. 2522
стр. 2523
стр. 2534
стр. 2535
стр. 253Лабораторный опыт № 31
стр. 255Лабораторный опыт № 32
стр. 255Лабораторный опыт № 33
стр. 256Лабораторный опыт № 34
стр. 257к содержанию
список заданийПомогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 2 расположенного на странице 252 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 252), автора: Габриелян (Олег Саргисович), ФГОС (старый) учебного пособия издательства Просвещение.
















