Номер 6, страница 247 - гдз по химии 8 класс учебник Габриелян

Авторы: Габриелян О. С.
Тип: Учебник
Издательство: Просвещение
Год издания: 2021 - 2026
Цвет обложки: белый
ISBN: 978-5-09-105083-7
Популярные ГДЗ в 8 классе
Глава 5. Растворение. Растворы. Реакции ионного обмена и окислительно-восстановительные реакции. Параграф 40. Основания, их классификация и свойства - номер 6, страница 247.
№6 (с. 247)
Условие. №6 (с. 247)

Решение. №6 (с. 247)
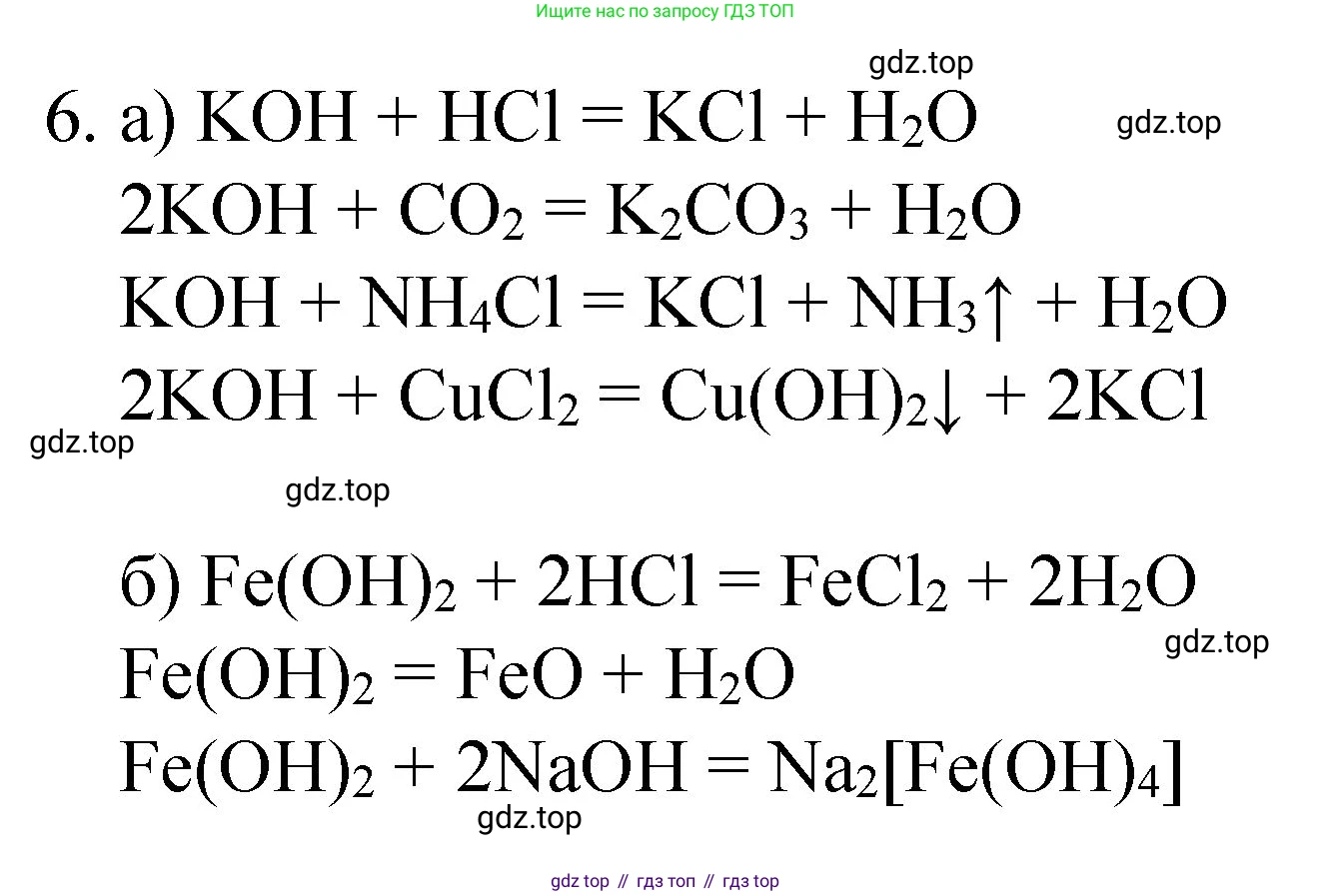
Решение 2. №6 (с. 247)
a) гидроксида калия
Гидроксид калия ($KOH$) — это сильное основание, щёлочь. Его химические свойства характерны для щелочей. Ниже приведены уравнения реакций, которые характеризуют эти свойства.
1. Реакция с кислотами (реакция нейтрализации). Щёлочи реагируют с кислотами, образуя соль и воду:
$KOH + HNO_3 \rightarrow KNO_3 + H_2O$
$2KOH + H_2SO_4 \rightarrow K_2SO_4 + 2H_2O$
2. Реакция с кислотными оксидами. Щёлочи реагируют с кислотными оксидами, образуя соль и воду:
$2KOH + SO_3 \rightarrow K_2SO_4 + H_2O$
$2KOH + CO_2 \rightarrow K_2CO_3 + H_2O$
3. Реакция с растворами солей. Щёлочи вступают в реакции ионного обмена с растворами солей, если один из продуктов реакции выпадает в осадок или выделяется в виде газа:
$2KOH + MgCl_2 \rightarrow Mg(OH)_2 \downarrow + 2KCl$
$KOH + NH_4Cl \xrightarrow{t} KCl + NH_3 \uparrow + H_2O$
4. Реакция с амфотерными оксидами и гидроксидами. В растворе образуются комплексные соли:
$2KOH + ZnO + H_2O \rightarrow K_2[Zn(OH)_4]$
$KOH + Al(OH)_3 \rightarrow K[Al(OH)_4]$
Ответ:
$KOH + HNO_3 \rightarrow KNO_3 + H_2O$
$2KOH + CO_2 \rightarrow K_2CO_3 + H_2O$
$2KOH + MgCl_2 \rightarrow Mg(OH)_2 \downarrow + 2KCl$
$KOH + Al(OH)_3 \rightarrow K[Al(OH)_4]$
б) гидроксида железа (II)
Гидроксид железа(II) ($Fe(OH)_2$) — это нерастворимое в воде основание. Оно обладает основными свойствами, а также является сильным восстановителем, легко окисляясь до соединений железа(III).
1. Реакция с кислотами. Как и все основания, гидроксид железа(II) реагирует с кислотами с образованием соли и воды:
$Fe(OH)_2 + 2HCl \rightarrow FeCl_2 + 2H_2O$
$Fe(OH)_2 + H_2SO_4 \rightarrow FeSO_4 + 2H_2O$
2. Термическое разложение. При нагревании без доступа воздуха нерастворимые основания разлагаются на соответствующий оксид и воду:
$Fe(OH)_2 \xrightarrow{t} FeO + H_2O$
3. Окисление. Это наиболее характерное свойство гидроксида железа(II). Белый осадок $Fe(OH)_2$ на воздухе быстро окисляется кислородом в присутствии воды до гидроксида железа(III) $Fe(OH)_3$, имеющего бурый цвет:
$4Fe(OH)_2 + O_2 + 2H_2O \rightarrow 4Fe(OH)_3 \downarrow$
Ответ:
$Fe(OH)_2 + 2HCl \rightarrow FeCl_2 + 2H_2O$
$Fe(OH)_2 \xrightarrow{t} FeO + H_2O$
$4Fe(OH)_2 + O_2 + 2H_2O \rightarrow 4Fe(OH)_3 \downarrow$
Другие задания:
Лабораторный опыт № 25
стр. 245Лабораторный опыт № 26
стр. 2461
стр. 2472
стр. 2473
стр. 2474
стр. 2475
стр. 2476
стр. 247Лабораторный опыт № 27
стр. 249Лабораторный опыт № 28
стр. 250Лабораторный опыт № 29
стр. 251Лабораторный опыт № 30
стр. 2521
стр. 2522
стр. 2523
стр. 253к содержанию
список заданийПомогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 6 расположенного на странице 247 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6 (с. 247), автора: Габриелян (Олег Саргисович), ФГОС (старый) учебного пособия издательства Просвещение.
















