Номер 1, страница 273 - гдз по химии 8 класс учебник Габриелян

Авторы: Габриелян О. С.
Тип: Учебник
Издательство: Просвещение
Год издания: 2021 - 2026
Цвет обложки: белый
ISBN: 978-5-09-105083-7
Популярные ГДЗ в 8 классе
Химический практикум №2. Свойства электролитов. Практическая работа № 8. Свойства кислот, оснований, оксидов и солей - номер 1, страница 273.
№1 (с. 273)
Условие. №1 (с. 273)

Решение. №1 (с. 273)

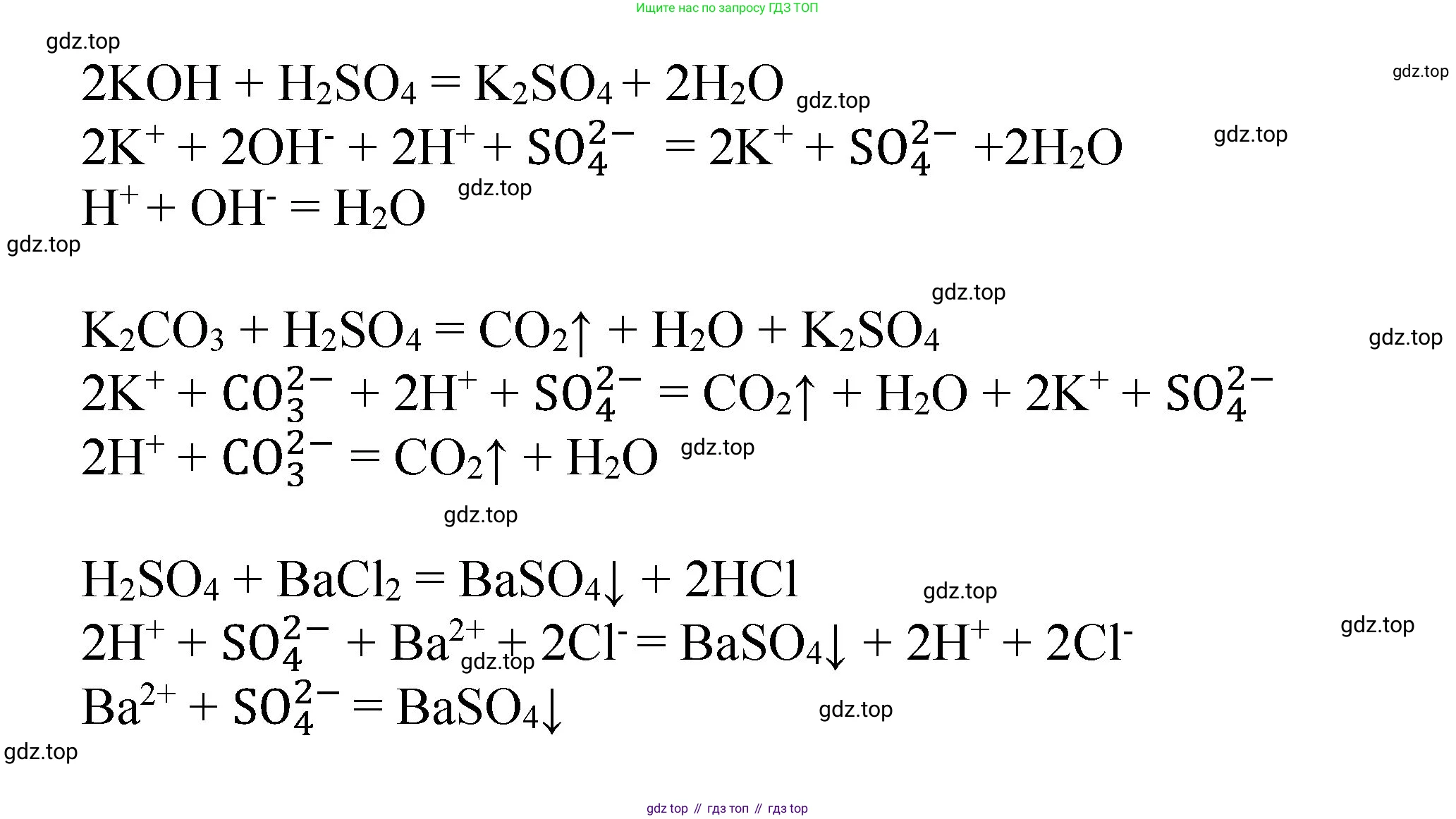
Решение 2. №1 (с. 273)
вариант 1 — соляной кислоты
Соляная кислота ($HCl$) является сильной одноосновной кислотой и проявляет все характерные для кислот химические свойства. Рассмотрим некоторые из них.
1. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода.
При взаимодействии соляной кислоты с цинком ($Zn$) выделяется газообразный водород и образуется соль хлорид цинка.
Молекулярное уравнение:
$Zn + 2HCl \rightarrow ZnCl_2 + H_2 \uparrow$
Полное ионное уравнение:
$Zn^0 + 2H^+ + 2Cl^- \rightarrow Zn^{2+} + 2Cl^- + H_2^0 \uparrow$
Сокращенное ионное уравнение:
$Zn^0 + 2H^+ \rightarrow Zn^{2+} + H_2^0 \uparrow$
Рассмотрим реакцию как окислительно-восстановительную:
$Zn^0 - 2e^- \rightarrow Zn^{2+}$ | 1 (процесс окисления, $Zn$ — восстановитель)
$2H^+ + 2e^- \rightarrow H_2^0$ | 1 (процесс восстановления, $H^+$ — окислитель)
2. Взаимодействие с основными оксидами.
Соляная кислота реагирует с оксидом меди(II) ($CuO$), который является основным оксидом. В результате реакции образуется растворимая соль хлорид меди(II) голубого цвета и вода.
Молекулярное уравнение:
$CuO + 2HCl \rightarrow CuCl_2 + H_2O$
Полное ионное уравнение: (оксид меди(II) — твердое вещество, на ионы не расписывается)
$CuO + 2H^+ + 2Cl^- \rightarrow Cu^{2+} + 2Cl^- + H_2O$
Сокращенное ионное уравнение:
$CuO + 2H^+ \rightarrow Cu^{2+} + H_2O$
3. Взаимодействие с основаниями (реакция нейтрализации).
При реакции соляной кислоты с гидроксидом натрия ($NaOH$) образуются соль хлорид натрия и вода. Это экзотермическая реакция.
Молекулярное уравнение:
$HCl + NaOH \rightarrow NaCl + H_2O$
Полное ионное уравнение:
$H^+ + Cl^- + Na^+ + OH^- \rightarrow Na^+ + Cl^- + H_2O$
Сокращенное ионное уравнение:
$H^+ + OH^- \rightarrow H_2O$
4. Взаимодействие с солями.
Реакция протекает, если образуется осадок, газ или слабый электролит. Реакция с нитратом серебра ($AgNO_3$) является качественной на хлорид-ион, так как выпадает белый творожистый осадок хлорида серебра ($AgCl$).
Молекулярное уравнение:
$HCl + AgNO_3 \rightarrow AgCl \downarrow + HNO_3$
Полное ионное уравнение:
$H^+ + Cl^- + Ag^+ + NO_3^- \rightarrow AgCl \downarrow + H^+ + NO_3^-$
Сокращенное ионное уравнение:
$Ag^+ + Cl^- \rightarrow AgCl \downarrow$
Ответ: Были рассмотрены реакции соляной кислоты с металлом, основным оксидом, основанием и солью, и записаны соответствующие молекулярные и ионные уравнения. Реакция с металлом проанализирована как окислительно-восстановительная.
вариант 2 — раствора серной кислоты
Раствор серной кислоты ($H_2SO_4$) является сильной двухосновной кислотой и проявляет все характерные для кислот химические свойства. В разбавленном растворе окислителем выступает ион водорода $H^+$.
1. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода.
При взаимодействии разбавленной серной кислоты с магнием ($Mg$) выделяется газообразный водород и образуется соль сульфат магния.
Молекулярное уравнение:
$Mg + H_2SO_4 \rightarrow MgSO_4 + H_2 \uparrow$
Полное ионное уравнение:
$Mg^0 + 2H^+ + SO_4^{2-} \rightarrow Mg^{2+} + SO_4^{2-} + H_2^0 \uparrow$
Сокращенное ионное уравнение:
$Mg^0 + 2H^+ \rightarrow Mg^{2+} + H_2^0 \uparrow$
Рассмотрим реакцию как окислительно-восстановительную:
$Mg^0 - 2e^- \rightarrow Mg^{2+}$ | 1 (процесс окисления, $Mg$ — восстановитель)
$2H^+ + 2e^- \rightarrow H_2^0$ | 1 (процесс восстановления, $H^+$ — окислитель)
2. Взаимодействие с основными оксидами.
Серная кислота реагирует с оксидом железа(III) ($Fe_2O_3$), который является основным оксидом. В результате реакции образуется растворимая соль сульфат железа(III) желто-коричневого цвета и вода.
Молекулярное уравнение:
$Fe_2O_3 + 3H_2SO_4 \rightarrow Fe_2(SO_4)_3 + 3H_2O$
Полное ионное уравнение: (оксид железа(III) — твердое вещество, на ионы не расписывается)
$Fe_2O_3 + 6H^+ + 3SO_4^{2-} \rightarrow 2Fe^{3+} + 3SO_4^{2-} + 3H_2O$
Сокращенное ионное уравнение:
$Fe_2O_3 + 6H^+ \rightarrow 2Fe^{3+} + 3H_2O$
3. Взаимодействие с основаниями (реакция нейтрализации).
При реакции серной кислоты с гидроксидом калия ($KOH$) образуются соль сульфат калия и вода.
Молекулярное уравнение:
$H_2SO_4 + 2KOH \rightarrow K_2SO_4 + 2H_2O$
Полное ионное уравнение:
$2H^+ + SO_4^{2-} + 2K^+ + 2OH^- \rightarrow 2K^+ + SO_4^{2-} + 2H_2O$
Сокращенное ионное уравнение (после сокращения на 2):
$H^+ + OH^- \rightarrow H_2O$
4. Взаимодействие с солями.
Реакция с солями бария (например, хлоридом бария $BaCl_2$) является качественной на сульфат-ион ($SO_4^{2-}$), так как выпадает белый кристаллический осадок сульфата бария ($BaSO_4$), нерастворимый в кислотах.
Молекулярное уравнение:
$H_2SO_4 + BaCl_2 \rightarrow BaSO_4 \downarrow + 2HCl$
Полное ионное уравнение:
$2H^+ + SO_4^{2-} + Ba^{2+} + 2Cl^- \rightarrow BaSO_4 \downarrow + 2H^+ + 2Cl^-$
Сокращенное ионное уравнение:
$Ba^{2+} + SO_4^{2-} \rightarrow BaSO_4 \downarrow$
Ответ: Были рассмотрены реакции раствора серной кислоты с металлом, основным оксидом, основанием и солью, и записаны соответствующие молекулярные и ионные уравнения. Реакция с металлом проанализирована как окислительно-восстановительная.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 1 расположенного на странице 273 к учебнику 2021 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 273), автора: Габриелян (Олег Саргисович), ФГОС (старый) учебного пособия издательства Просвещение.
















