Номер 3.64, страница 22, часть I - гдз по химии 8-9 класс задачник с помощником Гара, Габрусева
Авторы: Гара Н. Н., Габрусева Н. И.
Тип: Задачник с помощником
Издательство: Просвещение
Год издания: 2009 - 2025
Часть: I
Цвет обложки: зелёный, синий
ISBN: 978-5-09-037902-1
Популярные ГДЗ в 8 классе
Часть I. Вычисления по химическим формулам. 3. Массовая доля химического элемента. Вывод формулы вещества - номер 3.64, страница 22.
№3.64 (с. 22)
Условие. №3.64 (с. 22)
скриншот условия

3.64. Наименьшая массовая доля химического элемента железа в веществе, формула которого
1) $FeS$
2) $FeS_2$
3) $FeCO_3$
4) $CuFeS_2$
(Ответ подтвердите расчетом.)
Решение. №3.64 (с. 22)

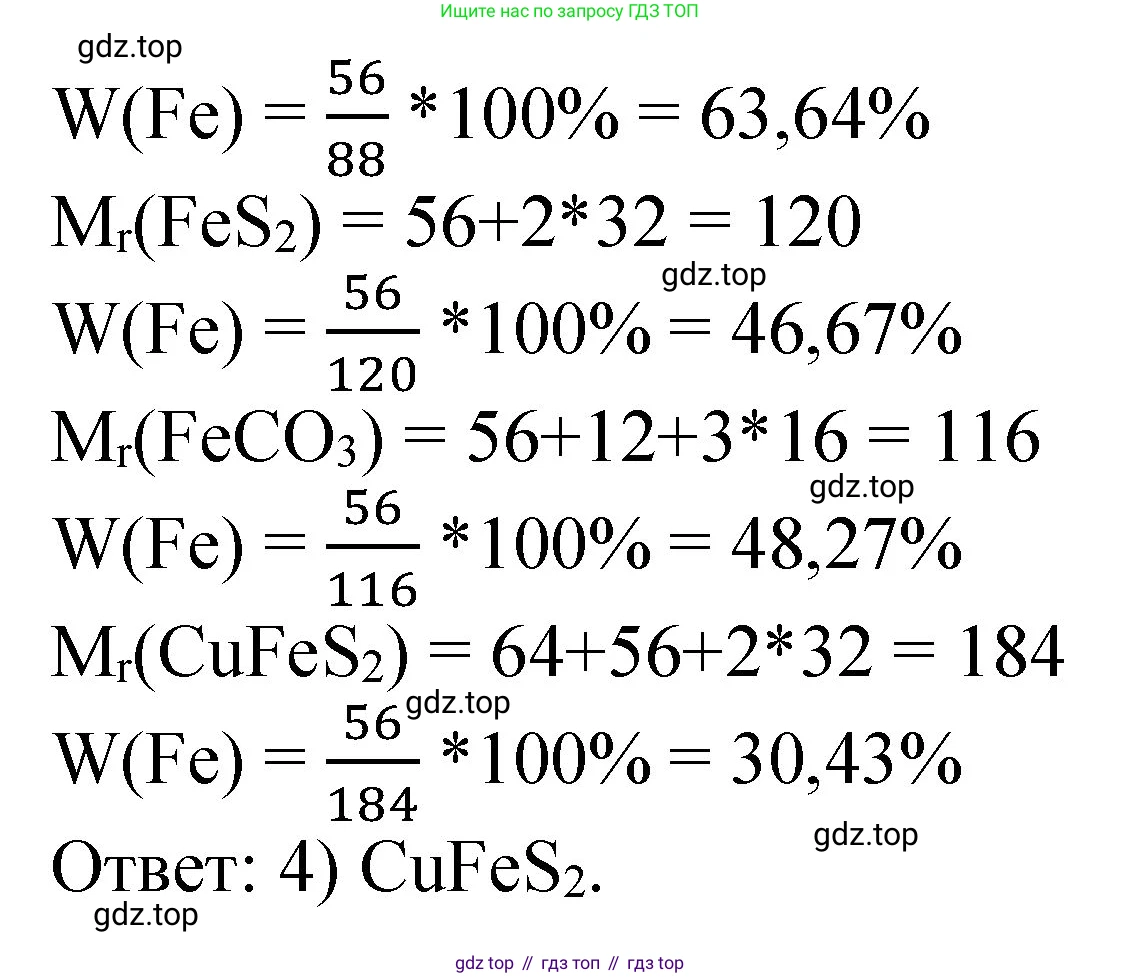
Решение 2. №3.64 (с. 22)
Для определения вещества с наименьшей массовой долей железа необходимо рассчитать эту долю для каждого из предложенных соединений. Массовая доля элемента в веществе вычисляется по формуле:
$ω(Э) = \frac{n \cdot Ar(Э)}{Mr(вещества)} \cdot 100\%$
где $ω(Э)$ – массовая доля элемента, $n$ – число атомов элемента в формуле, $Ar(Э)$ – относительная атомная масса элемента, $Mr(вещества)$ – относительная молекулярная масса вещества.
Дано:Относительные атомные массы (округленные):
- $Ar(Fe) = 56$
- $Ar(S) = 32$
- $Ar(C) = 12$
- $Ar(O) = 16$
- $Ar(Cu) = 64$
Найти:
Вещество с наименьшей массовой долей железа $ω(Fe)$.
Решение:Рассчитаем массовую долю железа для каждого соединения.
1) FeSОтносительная молекулярная масса сульфида железа(II):
$Mr(FeS) = Ar(Fe) + Ar(S) = 56 + 32 = 88$
Массовая доля железа:
$ω(Fe) = \frac{1 \cdot Ar(Fe)}{Mr(FeS)} = \frac{56}{88} \approx 0.6364$
В процентах: $0.6364 \cdot 100\% = 63.64\%$
Ответ: массовая доля железа в FeS составляет $63.64\%$.
2) FeS₂Относительная молекулярная масса дисульфида железа(II) (пирита):
$Mr(FeS_2) = Ar(Fe) + 2 \cdot Ar(S) = 56 + 2 \cdot 32 = 56 + 64 = 120$
Массовая доля железа:
$ω(Fe) = \frac{1 \cdot Ar(Fe)}{Mr(FeS_2)} = \frac{56}{120} \approx 0.4667$
В процентах: $0.4667 \cdot 100\% = 46.67\%$
Ответ: массовая доля железа в FeS₂ составляет $46.67\%$.
3) FeCO₃Относительная молекулярная масса карбоната железа(II):
$Mr(FeCO_3) = Ar(Fe) + Ar(C) + 3 \cdot Ar(O) = 56 + 12 + 3 \cdot 16 = 56 + 12 + 48 = 116$
Массовая доля железа:
$ω(Fe) = \frac{1 \cdot Ar(Fe)}{Mr(FeCO_3)} = \frac{56}{116} \approx 0.4828$
В процентах: $0.4828 \cdot 100\% = 48.28\%$
Ответ: массовая доля железа в FeCO₃ составляет $48.28\%$.
4) CuFeS₂Относительная молекулярная масса халькопирита:
$Mr(CuFeS_2) = Ar(Cu) + Ar(Fe) + 2 \cdot Ar(S) = 64 + 56 + 2 \cdot 32 = 64 + 56 + 64 = 184$
Массовая доля железа:
$ω(Fe) = \frac{1 \cdot Ar(Fe)}{Mr(CuFeS_2)} = \frac{56}{184} \approx 0.3043$
В процентах: $0.3043 \cdot 100\% = 30.43\%$
Ответ: массовая доля железа в CuFeS₂ составляет $30.43\%$.
Сравнивая полученные значения, видим, что наименьшая массовая доля железа ($30.43\%$) в веществе CuFeS₂.
Ответ:Наименьшая массовая доля химического элемента железа в веществе, формула которого 4) CuFeS₂.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8-9 класс, для упражнения номер 3.64 расположенного на странице 22 для I-й части к задачнику с помощником 2009 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3.64 (с. 22), авторов: Гара (Наталья Николаевна), Габрусева (Надежда Ивановна), I-й части учебного пособия издательства Просвещение.
















