Номер 2.8, страница 47, часть II - гдз по химии 8-9 класс задачник с помощником Гара, Габрусева
Авторы: Гара Н. Н., Габрусева Н. И.
Тип: Задачник с помощником
Издательство: Просвещение
Год издания: 2009 - 2026
Часть: II
Цвет обложки: зелёный, синий
ISBN: 978-5-09-037902-1
Популярные ГДЗ в 8 классе
Часть II. Вычисления по химическим уравнениям. 2. Вычисление массы (количества вещества, объема) продукта реакции, если известна масса исходного вещества, содержащего определенную долю примесей - номер 2.8, страница 47.
№2.8 (с. 47)
Условие. №2.8 (с. 47)
скриншот условия

2.8. Вычислите, какой объем углекислого газа (н. у.) выделится при обжиге известняка массой 1 т с массовой долей примесей 10%.
Решение. №2.8 (с. 47)
Решение 2. №2.8 (с. 47)
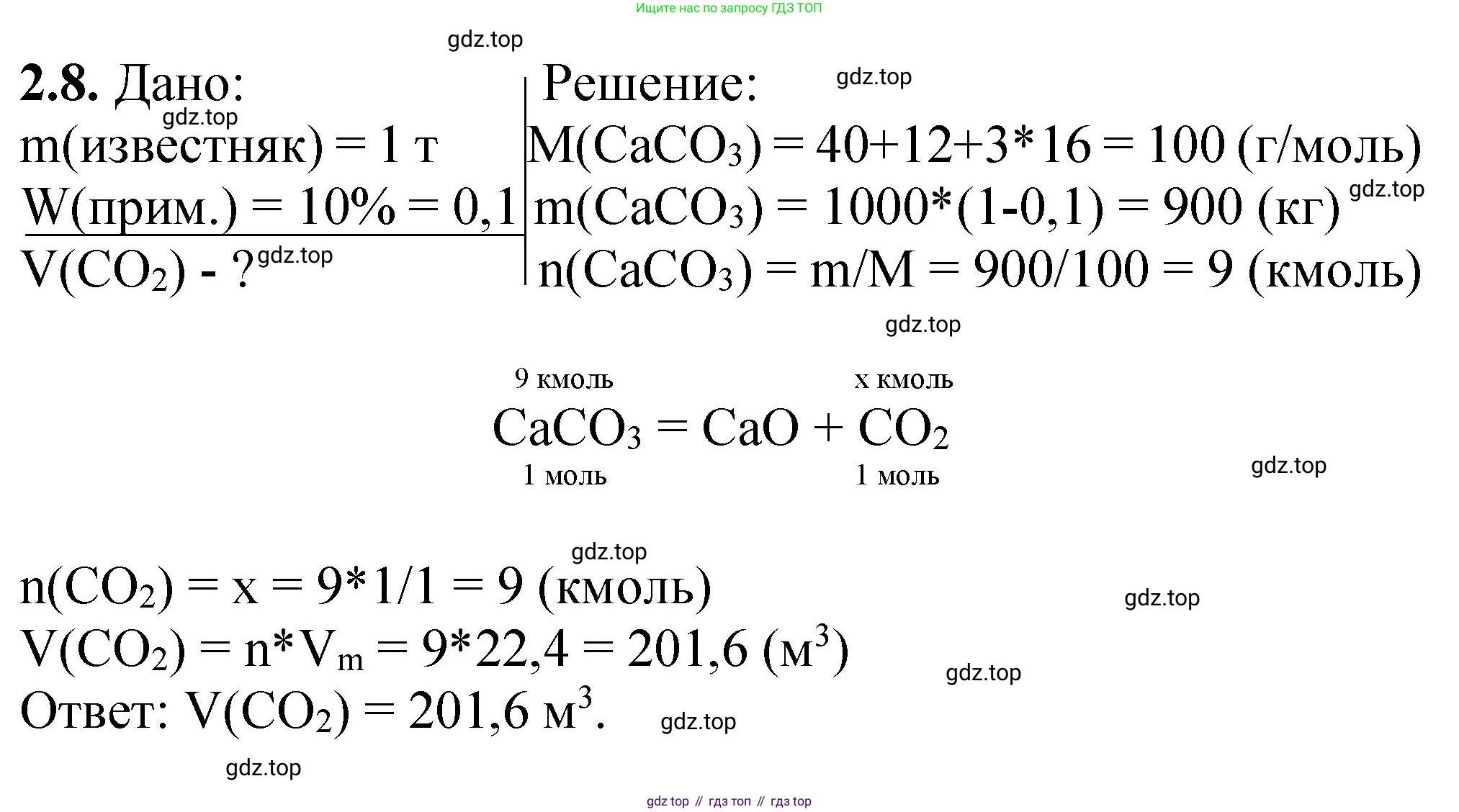
Дано
$m_{известняка} = 1 \text{ т}$
$\omega_{примесей} = 10\% = 0.1$
Условия: н. у. (нормальные условия)
Перевод в СИ:
$m_{известняка} = 1 \text{ т} = 1000 \text{ кг}$
Найти:
$V(CO_2) - ?$
Решение
1. Запишем уравнение реакции обжига известняка. Известняк — это природный минерал, основной компонент которого карбонат кальция ($CaCO_3$). Примеси в реакции не участвуют. При термическом разложении (обжиге) карбоната кальция образуются оксид кальция ($CaO$) и углекислый газ ($CO_2$):
$CaCO_3 \xrightarrow{t^\circ} CaO + CO_2$
2. Определим массу чистого карбоната кальция ($CaCO_3$) в известняке. Массовая доля примесей составляет 10%, следовательно, массовая доля чистого $CaCO_3$ равна:
$\omega(CaCO_3) = 100\% - \omega_{примесей} = 100\% - 10\% = 90\% = 0.9$
Теперь вычислим массу чистого $CaCO_3$:
$m(CaCO_3) = m_{известняка} \times \omega(CaCO_3) = 1000 \text{ кг} \times 0.9 = 900 \text{ кг}$
3. Вычислим молярную массу карбоната кальция ($CaCO_3$):
$M(CaCO_3) = M(Ca) + M(C) + 3 \times M(O) = 40 + 12 + 3 \times 16 = 100 \text{ г/моль} = 100 \text{ кг/кмоль}$
4. Найдем количество вещества ($ν$) карбоната кальция, вступившего в реакцию:
$\nu(CaCO_3) = \frac{m(CaCO_3)}{M(CaCO_3)} = \frac{900 \text{ кг}}{100 \text{ кг/кмоль}} = 9 \text{ кмоль}$
5. Согласно уравнению реакции, из 1 моль $CaCO_3$ образуется 1 моль $CO_2$. Следовательно, количество вещества углекислого газа равно количеству вещества карбоната кальция:
$\nu(CO_2) = \nu(CaCO_3) = 9 \text{ кмоль}$
6. Вычислим объем выделившегося углекислого газа при нормальных условиях (н. у.). При н. у. молярный объем любого газа ($V_m$) составляет 22.4 л/моль или 22.4 м³/кмоль.
$V(CO_2) = \nu(CO_2) \times V_m = 9 \text{ кмоль} \times 22.4 \frac{\text{м}^3}{\text{кмоль}} = 201.6 \text{ м}^3$
Ответ: при обжиге 1 т известняка выделится 201.6 м³ углекислого газа.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8-9 класс, для упражнения номер 2.8 расположенного на странице 47 для II-й части к задачнику с помощником 2009 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2.8 (с. 47), авторов: Гара (Наталья Николаевна), Габрусева (Надежда Ивановна), II-й части учебного пособия издательства Просвещение.
















