Номер 1, страница 75, часть III - гдз по химии 8-9 класс задачник с помощником Гара, Габрусева
Авторы: Гара Н. Н., Габрусева Н. И.
Тип: Задачник с помощником
Издательство: Просвещение
Год издания: 2009 - 2025
Часть: III
Цвет обложки: зелёный, синий
ISBN: 978-5-09-037902-1
Популярные ГДЗ в 8 классе
Часть III. Качественные задачи - номер 1, страница 75.
№1 (с. 75)
Условие. №1 (с. 75)
скриншот условия

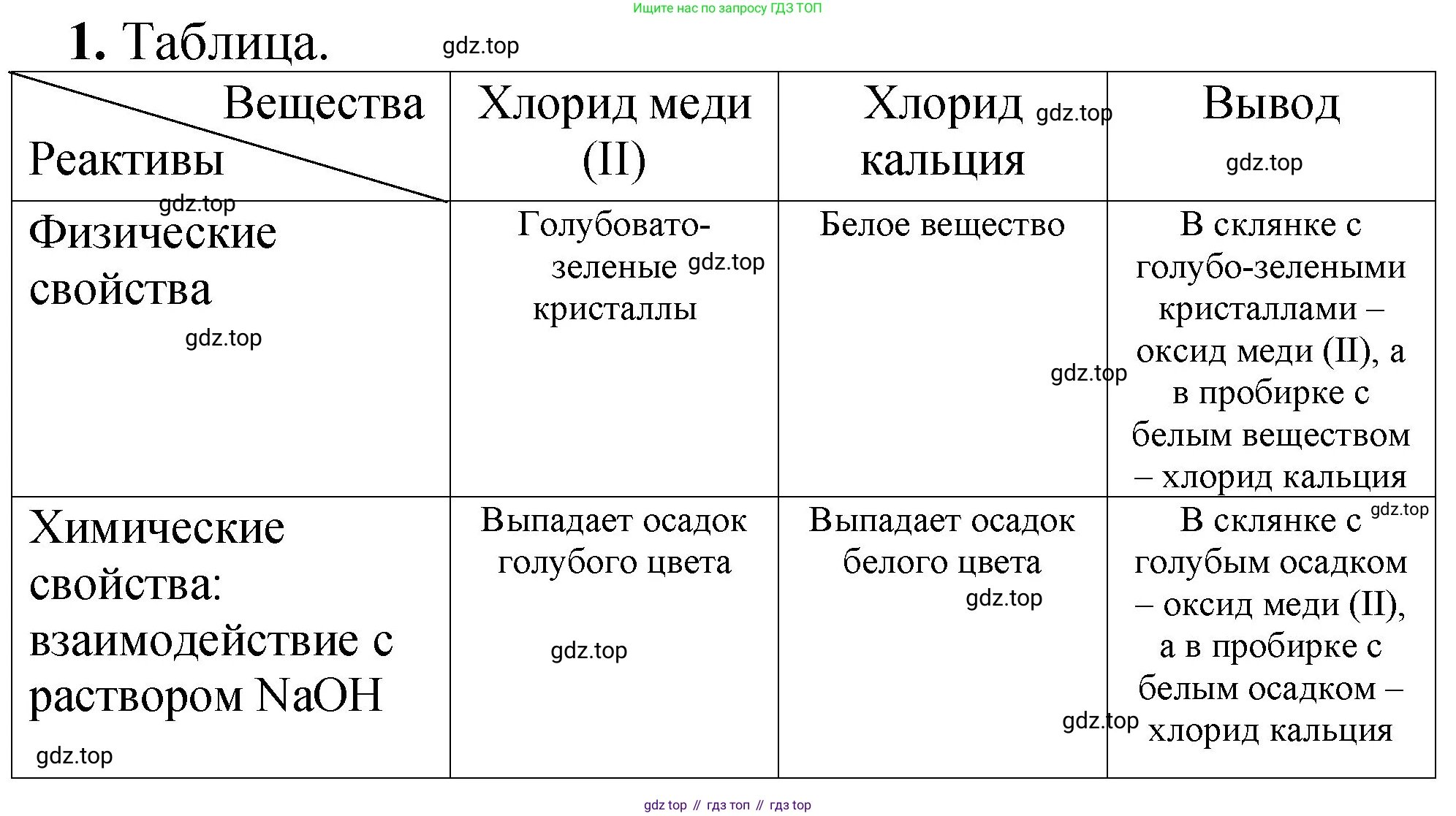
1. Как распознать по внешнему виду хлорид меди(II) и хлорид кальция, если они находятся в склянках без этикеток? Как доказать это химическими опытами?
Решение. №1 (с. 75)
Решение 2. №1 (с. 75)
Как распознать по внешнему виду хлорид меди(II) и хлорид кальция, если они находятся в склянках без этикеток?
Хлорид меди(II) и хлорид кальция можно легко различить по их внешнему виду, в частности, по цвету. Это связано с тем, что соединения переходных металлов (к которым относится медь) в большинстве своем окрашены, в то время как соединения щелочноземельных металлов (к которым относится кальций) обычно являются белыми.
- Хлорид меди(II) ($CuCl_2$): В безводном виде это кристаллический порошок коричневого цвета. Однако в лабораторных условиях чаще всего встречается его кристаллогидрат — дигидрат хлорида меди(II) ($CuCl_2 \cdot 2H_2O$), который представляет собой кристаллы характерного сине-зеленого цвета.
- Хлорид кальция ($CaCl_2$): Это белое кристаллическое вещество. Его кристаллогидраты ($CaCl_2 \cdot nH_2O$) также имеют белый цвет.
Следовательно, можно сделать предварительный вывод, что склянка с сине-зелеными кристаллами содержит хлорид меди(II), а склянка с белыми кристаллами — хлорид кальция.
Ответ: Хлорид меди(II) (в виде гидрата) представляет собой кристаллы сине-зеленого цвета, в то время как хлорид кальция — белые кристаллы. Их можно различить по этому цвету.
Как доказать это химическими опытами?
Чтобы экспериментально подтвердить состав веществ в каждой склянке, необходимо провести качественные реакции на катионы меди ($Cu^{2+}$) и кальция ($Ca^{2+}$). Эксперимент можно провести по следующему плану:
- Растворение в воде. Отберем пробы веществ из каждой склянки и растворим их в воде в отдельных пробирках. Уже на этом этапе мы увидим различие:
- Раствор хлорида меди(II) будет иметь синий или зеленый цвет (в зависимости от концентрации).
- Раствор хлорида кальция будет бесцветным.
- Проведение качественных реакций.
- Тест на ион меди(II) ($Cu^{2+}$): К полученному окрашенному раствору добавим по каплям раствор щелочи (например, гидроксида натрия $NaOH$). В результате реакции выпадет объемистый студенистый осадок синего цвета — гидроксид меди(II) ($Cu(OH)_2$).
Уравнение реакции: $CuCl_2 + 2NaOH \rightarrow Cu(OH)_2 \downarrow + 2NaCl$ - Тест на ион кальция ($Ca^{2+}$): К бесцветному раствору добавим раствор карбоната натрия ($Na_2CO_3$). Образуется белый кристаллический осадок карбоната кальция ($CaCO_3$).
Уравнение реакции: $CaCl_2 + Na_2CO_3 \rightarrow CaCO_3 \downarrow + 2NaCl$
- Тест на ион меди(II) ($Cu^{2+}$): К полученному окрашенному раствору добавим по каплям раствор щелочи (например, гидроксида натрия $NaOH$). В результате реакции выпадет объемистый студенистый осадок синего цвета — гидроксид меди(II) ($Cu(OH)_2$).
- Альтернативный способ подтверждения (пламенный тест). Этот метод является очень наглядным. Небольшое количество каждого кристаллического вещества вносят в пламя газовой горелки (например, на кончике чистой нихромовой или платиновой проволоки).
- Пламя окрасится в ярко-зеленый или сине-зеленый цвет, что характерно для ионов меди.
- Пламя окрасится в кирпично-красный цвет, что является качественной реакцией на ионы кальция.
Ответ: Для доказательства необходимо провести качественные реакции. При добавлении раствора щелочи ($NaOH$) к раствору хлорида меди(II) выпадает синий осадок $Cu(OH)_2$. При добавлении раствора карбоната натрия ($Na_2CO_3$) к раствору хлорида кальция выпадает белый осадок $CaCO_3$. Также можно провести пламенный тест: соли меди окрашивают пламя в зеленый цвет, а соли кальция — в кирпично-красный.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8-9 класс, для упражнения номер 1 расположенного на странице 75 для III-й части к задачнику с помощником 2009 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 75), авторов: Гара (Наталья Николаевна), Габрусева (Надежда Ивановна), III-й части учебного пособия издательства Просвещение.
















