Номер 7, страница 76, часть III - гдз по химии 8-9 класс задачник с помощником Гара, Габрусева
Авторы: Гара Н. Н., Габрусева Н. И.
Тип: Задачник с помощником
Издательство: Просвещение
Год издания: 2009 - 2026
Часть: III
Цвет обложки: зелёный, синий
ISBN: 978-5-09-037902-1
Популярные ГДЗ в 8 классе
Часть III. Качественные задачи - номер 7, страница 76.
№7 (с. 76)
Условие. №7 (с. 76)
скриншот условия

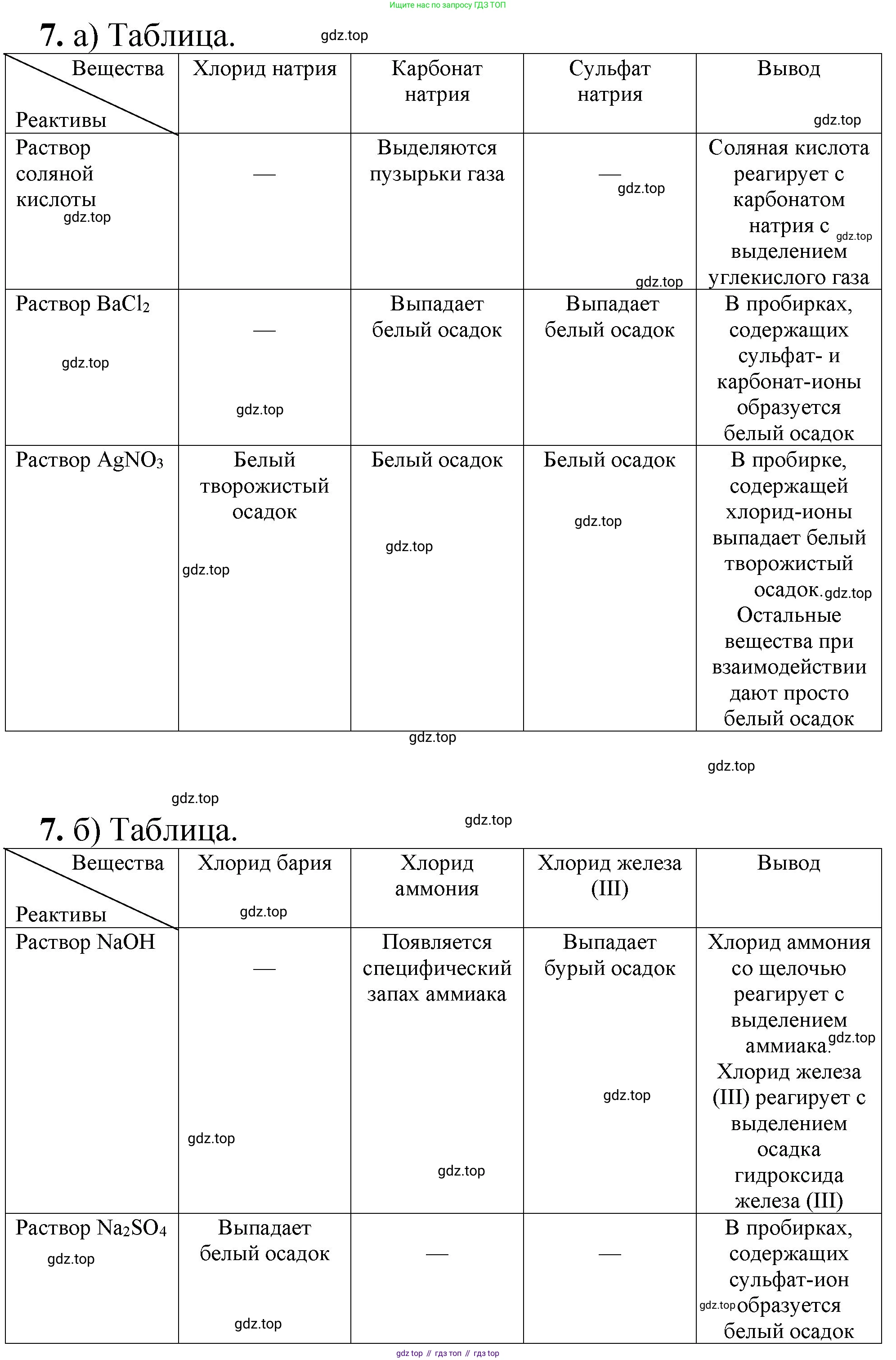
7. Определите опытным путем, какие растворы находятся в трех склянках без этикеток:
а) хлорид натрия, карбонат натрия, сульфат натрия;
б) хлорид бария, хлорид аммония, хлорид железа(III).
Решение. №7 (с. 76)
Решение 2. №7 (с. 76)
а) хлорид натрия, карбонат натрия, сульфат натрия;
Решение
Для определения веществ в трех склянках без этикеток необходимо провести качественные реакции на анионы $CO_3^{2-}$, $SO_4^{2-}$ и $Cl^-$. Все три соли образованы одним и тем же катионом натрия ($Na^+$), поэтому распознавание проводим по анионам.
- Сначала пронумеруем склянки (№1, №2, №3) и отберем из каждой по небольшой пробе в отдельные пробирки.
- В каждую из трех пробирок добавим несколько капель раствора сильной кислоты, например, соляной ($HCl$) или серной ($H_2SO_4$). В той пробирке, где начнется бурное выделение газа без цвета и запаха (углекислого газа), находится раствор карбоната натрия ($Na_2CO_3$).
Уравнение реакции:
$Na_2CO_3 + 2HCl \rightarrow 2NaCl + H_2O + CO_2\uparrow$
Ионное уравнение:
$2Na^+ + CO_3^{2-} + 2H^+ + 2Cl^- \rightarrow 2Na^+ + 2Cl^- + H_2O + CO_2\uparrow$
$CO_3^{2-} + 2H^+ \rightarrow H_2O + CO_2\uparrow$ - Теперь у нас остались две пробирки с растворами хлорида натрия ($NaCl$) и сульфата натрия ($Na_2SO_4$). Чтобы их различить, отберем новые пробы из соответствующих склянок и добавим к ним по несколько капель раствора хлорида бария ($BaCl_2$) или нитрата бария ($Ba(NO_3)_2$). В пробирке, где выпадет белый мелкокристаллический осадок сульфата бария, находится сульфат натрия ($Na_2SO_4$). Этот осадок не растворяется в кислотах.
Уравнение реакции:
$Na_2SO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + 2NaCl$
Ионное уравнение:
$2Na^+ + SO_4^{2-} + Ba^{2+} + 2Cl^- \rightarrow BaSO_4\downarrow + 2Na^+ + 2Cl^-$
$Ba^{2+} + SO_4^{2-} \rightarrow BaSO_4\downarrow$ - Методом исключения определяем, что в оставшейся третьей склянке находится раствор хлорида натрия ($NaCl$). Для проверки можно добавить к пробе этого раствора нитрат серебра ($AgNO_3$), в результате чего выпадет белый творожистый осадок хлорида серебра ($AgCl$).
Ответ: Чтобы определить вещества, нужно сначала добавить к пробам из трех склянок раствор сильной кислоты; выделение газа укажет на карбонат натрия. Затем к двум оставшимся пробам добавить раствор соли бария; выпадение белого осадка укажет на сульфат натрия. В оставшейся склянке будет хлорид натрия.
б) хлорид бария, хлорид аммония, хлорид железа(III);
Решение
В данном случае все три соли содержат одинаковый анион ($Cl^-$), поэтому распознавание необходимо проводить по катионам: $Ba^{2+}$, $NH_4^+$ и $Fe^{3+}$.
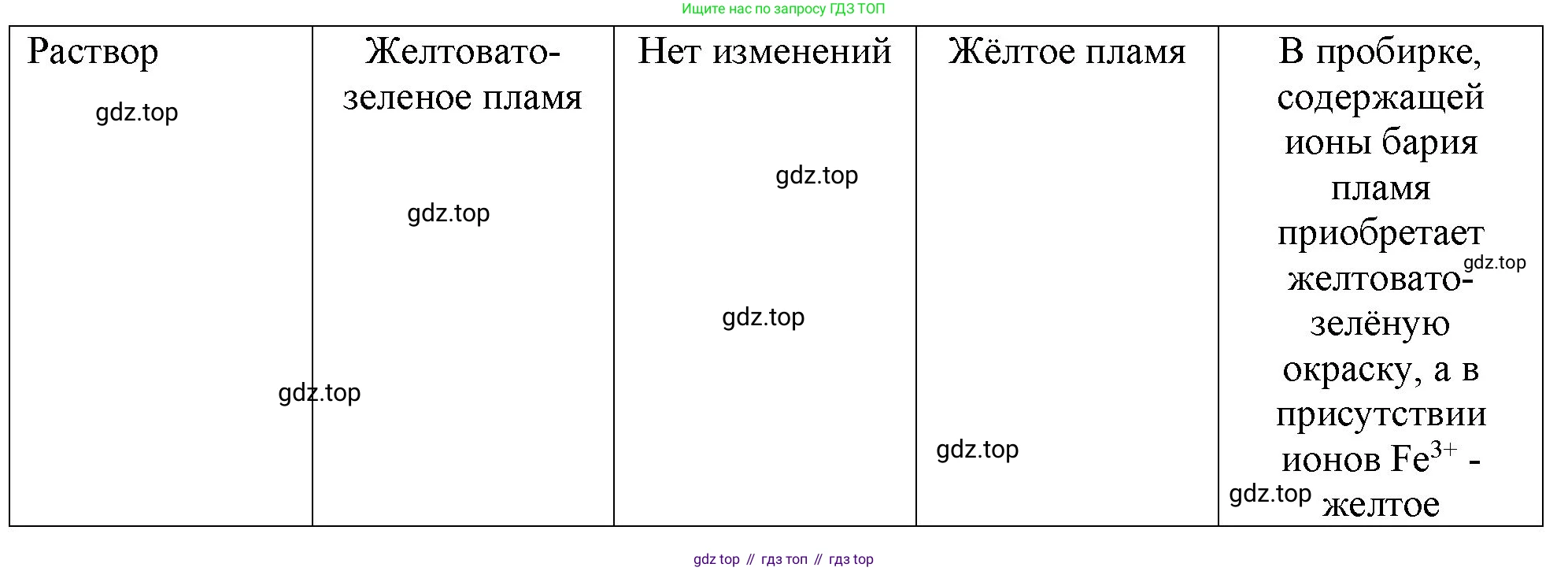
- Первоначально можно осмотреть растворы. Раствор хлорида железа(III) ($FeCl_3$) имеет характерную желто-бурую окраску из-за гидролиза и присутствия гидратированных ионов $Fe^{3+}$. Растворы хлорида бария ($BaCl_2$) и хлорида аммония ($NH_4Cl$) бесцветны. Таким образом, склянку с окрашенным раствором можно сразу определить как $FeCl_3$.
- Для надежного определения всех трех веществ проведем химический эксперимент. Пронумеруем склянки и отберем из каждой пробы в отдельные пробирки. Добавим в каждую пробирку по несколько капель раствора щелочи, например, гидроксида натрия ($NaOH$).
- В пробирке с хлоридом железа(III) ($FeCl_3$) сразу же выпадет объемистый бурый осадок гидроксида железа(III).
Уравнение реакции:
$FeCl_3 + 3NaOH \rightarrow Fe(OH)_3\downarrow + 3NaCl$
Ионное уравнение:
$Fe^{3+} + 3OH^- \rightarrow Fe(OH)_3\downarrow$ - В пробирке с хлоридом аммония ($NH_4Cl$) при добавлении щелочи и легком нагревании будет выделяться газ с резким характерным запахом (аммиак). Его можно обнаружить по запаху или с помощью влажной красной лакмусовой бумажки, которая посинеет.
Уравнение реакции:
$NH_4Cl + NaOH \xrightarrow{t} NaCl + H_2O + NH_3\uparrow$
Ионное уравнение:
$NH_4^+ + OH^- \xrightarrow{t} H_2O + NH_3\uparrow$ - В пробирке с хлоридом бария ($BaCl_2$) при добавлении раствора $NaOH$ видимых изменений не произойдет. Таким образом, эта пробирка идентифицирована методом исключения. Для подтверждения можно к новой пробе из этой склянки добавить раствор, содержащий сульфат-ионы, например, серную кислоту ($H_2SO_4$) или сульфат натрия ($Na_2SO_4$). Выпадет белый плотный осадок сульфата бария.
Уравнение реакции:
$BaCl_2 + Na_2SO_4 \rightarrow BaSO_4\downarrow + 2NaCl$
Ионное уравнение:
$Ba^{2+} + SO_4^{2-} \rightarrow BaSO_4\downarrow$
Ответ: Хлорид железа(III) можно определить по желто-бурому цвету раствора и по выпадению бурого осадка при добавлении щелочи. Хлорид аммония определяется по выделению аммиака с резким запахом при добавлении щелочи и нагревании. Хлорид бария не реагирует со щелочью, но дает белый осадок с растворами сульфатов.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8-9 класс, для упражнения номер 7 расположенного на странице 76 для III-й части к задачнику с помощником 2009 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №7 (с. 76), авторов: Гара (Наталья Николаевна), Габрусева (Надежда Ивановна), III-й части учебного пособия издательства Просвещение.
















