Номер 10, страница 76, часть III - гдз по химии 8-9 класс задачник с помощником Гара, Габрусева
Авторы: Гара Н. Н., Габрусева Н. И.
Тип: Задачник с помощником
Издательство: Просвещение
Год издания: 2009 - 2026
Часть: III
Цвет обложки: зелёный, синий
ISBN: 978-5-09-037902-1
Популярные ГДЗ в 8 классе
Часть III. Качественные задачи - номер 10, страница 76.
№10 (с. 76)
Условие. №10 (с. 76)
скриншот условия

10. Какие реактивы потребуются для проведения химических реакций, соответствующих приведенным схемам?
a) $Ba^{2+} + SO_{4}^{2-} \rightarrow BaSO_{4}$
б) $Cu^{2+} + 2OH^{-} \rightarrow Cu(OH)_{2}$
в) $2H^{+} + CO_{3}^{2-} \rightarrow H_{2}O + CO_{2}$
Проделайте эти опыты, выделите осадки. Запишите уравнения химических реакций в молекулярной форме.
Решение. №10 (с. 76)
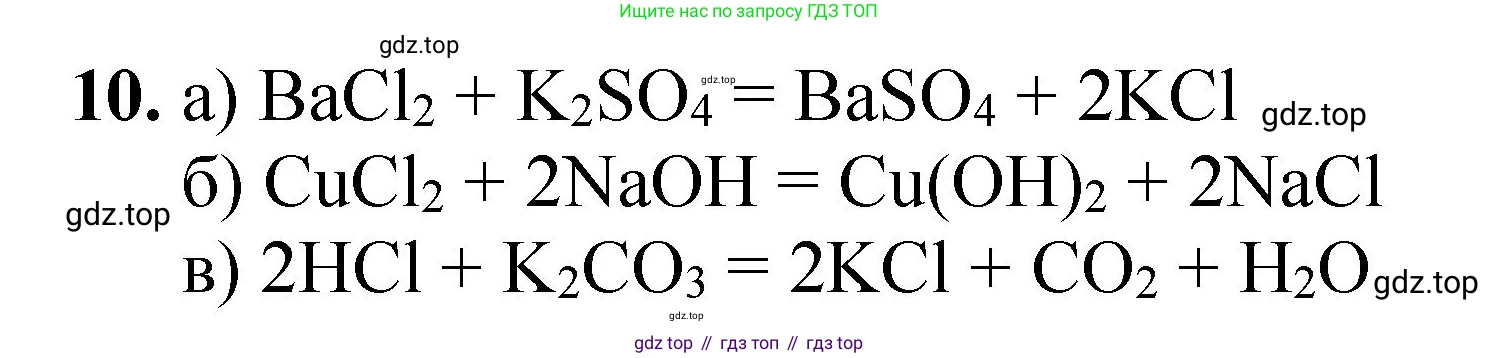
Решение 2. №10 (с. 76)
Для проведения данных химических реакций необходимо подобрать растворимые в воде вещества, которые при диссоциации образуют требуемые ионы. Запишем молекулярные уравнения для каждой схемы.
а) $Ba^{2+} + SO_4^{2-} \rightarrow BaSO_4$
Решение
Для этой реакции нужен источник ионов бария $Ba^{2+}$ и источник сульфат-ионов $SO_4^{2-}$. В качестве реагентов можно взять любую растворимую соль бария (например, хлорид бария $BaCl_2$) и любую растворимую соль-сульфат или серную кислоту (например, сульфат натрия $Na_2SO_4$). При смешивании их растворов выпадает белый мелкокристаллический осадок сульфата бария.
Уравнение реакции в молекулярной форме:
$BaCl_2 + Na_2SO_4 \rightarrow BaSO_4\downarrow + 2NaCl$
Ответ: $BaCl_2 + Na_2SO_4 \rightarrow BaSO_4\downarrow + 2NaCl$
б) $Cu^{2+} + 2OH^{-} \rightarrow Cu(OH)_2$
Решение
В данном случае требуется источник ионов меди(II) $Cu^{2+}$ и гидроксид-ионов $OH^{-}$. В качестве источника ионов меди можно использовать любую растворимую соль меди(II) (например, сульфат меди(II) $CuSO_4$, раствор которого имеет голубой цвет). Источником гидроксид-ионов является любая щелочь (растворимое основание), например, гидроксид натрия $NaOH$. При добавлении раствора щелочи к раствору соли меди образуется голубой студенистый (гелеобразный) осадок гидроксида меди(II).
Уравнение реакции в молекулярной форме:
$CuSO_4 + 2NaOH \rightarrow Cu(OH)_2\downarrow + Na_2SO_4$
Ответ: $CuSO_4 + 2NaOH \rightarrow Cu(OH)_2\downarrow + Na_2SO_4$
в) $2H^{+} + CO_3^{2-} \rightarrow H_2O + CO_2$
Решение
Для этой реакции нужен источник ионов водорода $H^{+}$ (любая сильная кислота, например, соляная кислота $HCl$) и источник карбонат-ионов $CO_3^{2-}$ (любой растворимый карбонат, например, карбонат натрия $Na_2CO_3$). При взаимодействии кислоты с карбонатом происходит бурная реакция с выделением бесцветного газа без запаха — углекислого газа ($CO_2$). В данном случае осадок не образуется, а наблюдается "вскипание" или выделение пузырьков газа.
Уравнение реакции в молекулярной форме:
$Na_2CO_3 + 2HCl \rightarrow 2NaCl + H_2O + CO_2\uparrow$
Ответ: $Na_2CO_3 + 2HCl \rightarrow 2NaCl + H_2O + CO_2\uparrow$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8-9 класс, для упражнения номер 10 расположенного на странице 76 для III-й части к задачнику с помощником 2009 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №10 (с. 76), авторов: Гара (Наталья Николаевна), Габрусева (Надежда Ивановна), III-й части учебного пособия издательства Просвещение.
















