Номер 8, страница 76, часть III - гдз по химии 8-9 класс задачник с помощником Гара, Габрусева
Авторы: Гара Н. Н., Габрусева Н. И.
Тип: Задачник с помощником
Издательство: Просвещение
Год издания: 2009 - 2026
Часть: III
Цвет обложки: зелёный, синий
ISBN: 978-5-09-037902-1
Популярные ГДЗ в 8 классе
Часть III. Качественные задачи - номер 8, страница 76.
№8 (с. 76)
Условие. №8 (с. 76)
скриншот условия

8. Подтвердите разными способами качественный состав веществ: соляная кислота ($ \text{HCl} $), серная кислота ($ \text{H}_2\text{SO}_4 $), сульфат меди(II) ($ \text{CuSO}_4 $), хлорид железа(III) ($ \text{FeCl}_3 $).
Решение. №8 (с. 76)
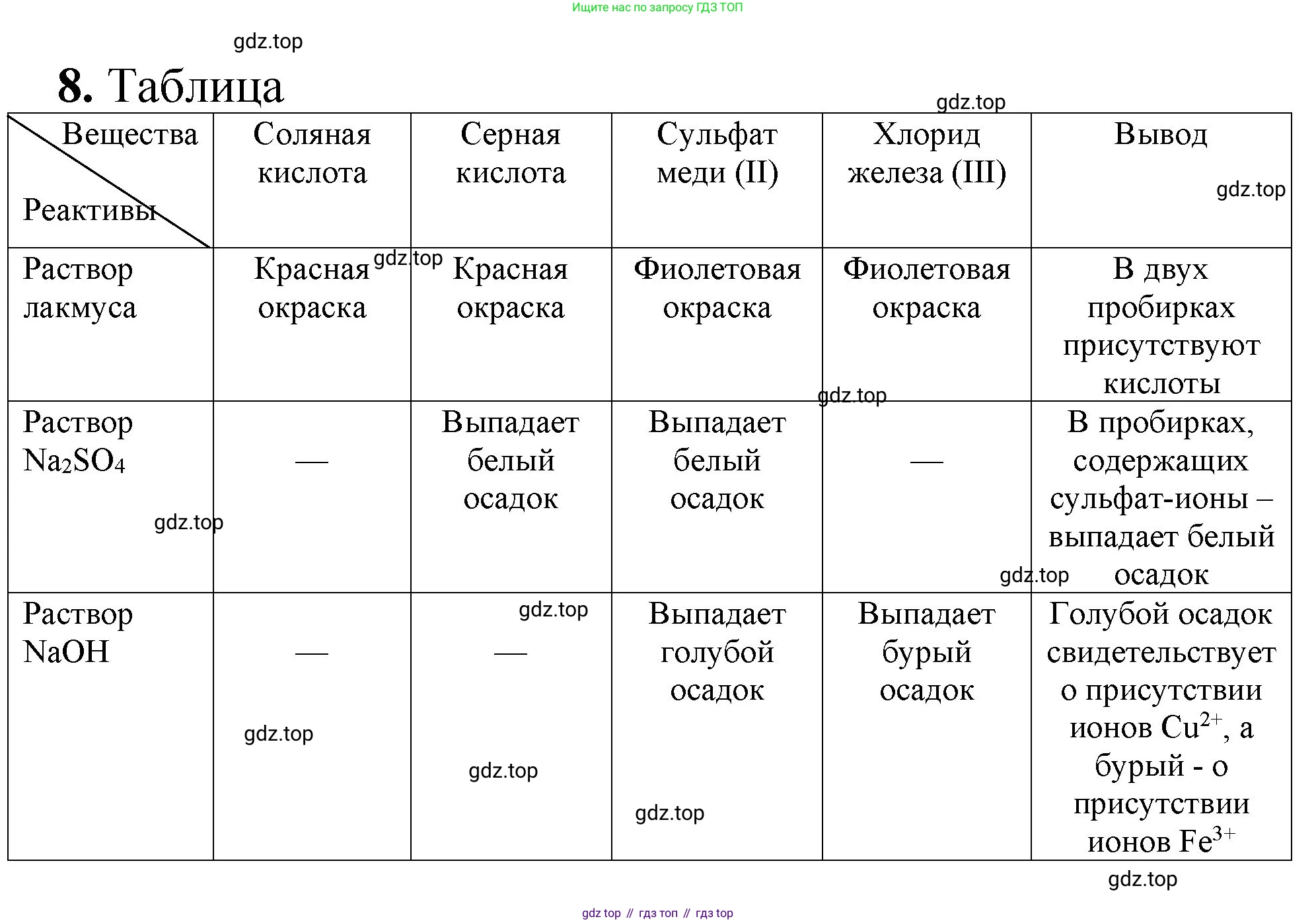
Решение 2. №8 (с. 76)
Соляная кислота
Качественный состав соляной кислоты ($HCl$) можно подтвердить, определив наличие ионов водорода ($H^+$) и хлорид-ионов ($Cl^-$).
1. Определение катионов водорода ($H^+$):
Наличие кислотной среды, создаваемой ионами $H^+$, можно доказать с помощью индикаторов. Например, лакмусовая бумажка в растворе соляной кислоты окрасится в красный цвет. Метиловый оранжевый также станет красным.
Другой способ — реакция с активным металлом, стоящим в ряду активности до водорода, например, с цинком. При добавлении гранулы цинка в пробирку с соляной кислотой будет наблюдаться выделение пузырьков газа (водорода), который можно собрать и поджечь — раздастся характерный "лающий" хлопок.
Уравнение реакции: $Zn + 2HCl \rightarrow ZnCl_2 + H_2\uparrow$
2. Определение хлорид-анионов ($Cl^-$):
Качественной реакцией на хлорид-ион является реакция с раствором нитрата серебра ($AgNO_3$). При добавлении нескольких капель нитрата серебра к раствору соляной кислоты выпадает белый творожистый осадок хлорида серебра ($AgCl$), нерастворимый в кислотах.
Уравнение реакции: $HCl + AgNO_3 \rightarrow AgCl\downarrow + HNO_3$
Сокращенное ионное уравнение: $Ag^+ + Cl^- \rightarrow AgCl\downarrow$
Ответ: В составе соляной кислоты экспериментально подтверждено наличие катионов водорода ($H^+$) и хлорид-анионов ($Cl^-$).
Серная кислота
Качественный состав серной кислоты ($H_2SO_4$) можно подтвердить, определив наличие ионов водорода ($H^+$) и сульфат-ионов ($SO_4^{2-}$).
1. Определение катионов водорода ($H^+$):
Аналогично соляной кислоте, наличие ионов $H^+$ доказывается с помощью индикаторов (лакмус станет красным) или реакцией с активными металлами, например, с магнием.
Уравнение реакции: $Mg + H_2SO_4 \rightarrow MgSO_4 + H_2\uparrow$
2. Определение сульфат-анионов ($SO_4^{2-}$):
Качественной реакцией на сульфат-ион является реакция с растворимыми солями бария, например, хлоридом бария ($BaCl_2$). При добавлении раствора хлорида бария к серной кислоте образуется белый мелкокристаллический осадок сульфата бария ($BaSO_4$), нерастворимый в сильных кислотах.
Уравнение реакции: $H_2SO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + 2HCl$
Сокращенное ионное уравнение: $Ba^{2+} + SO_4^{2-} \rightarrow BaSO_4\downarrow$
Ответ: В составе серной кислоты экспериментально подтверждено наличие катионов водорода ($H^+$) и сульфат-анионов ($SO_4^{2-}$).
Сульфат меди(II)
Качественный состав сульфата меди(II) ($CuSO_4$) можно подтвердить, определив наличие катионов меди(II) ($Cu^{2+}$) и сульфат-ионов ($SO_4^{2-}$).
1. Определение катионов меди(II) ($Cu^{2+}$):
Во-первых, водный раствор сульфата меди(II) имеет характерный голубой цвет, что указывает на присутствие гидратированных ионов $Cu^{2+}$.
Во-вторых, качественной реакцией является взаимодействие с раствором щелочи, например, гидроксида натрия ($NaOH$). При этом образуется голубой студенистый (гелеобразный) осадок гидроксида меди(II) ($Cu(OH)_2$).
Уравнение реакции: $CuSO_4 + 2NaOH \rightarrow Cu(OH)_2\downarrow + Na_2SO_4$
Сокращенное ионное уравнение: $Cu^{2+} + 2OH^- \rightarrow Cu(OH)_2\downarrow$
2. Определение сульфат-анионов ($SO_4^{2-}$):
Проводится реакция с раствором хлорида бария ($BaCl_2$). В результате образуется белый осадок сульфата бария ($BaSO_4$).
Уравнение реакции: $CuSO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + CuCl_2$
Сокращенное ионное уравнение: $Ba^{2+} + SO_4^{2-} \rightarrow BaSO_4\downarrow$
Ответ: В составе сульфата меди(II) экспериментально подтверждено наличие катионов меди(II) ($Cu^{2+}$) и сульфат-анионов ($SO_4^{2-}$).
Хлорид железа(III)
Качественный состав хлорида железа(III) ($FeCl_3$) можно подтвердить, определив наличие катионов железа(III) ($Fe^{3+}$) и хлорид-ионов ($Cl^-$).
1. Определение катионов железа(III) ($Fe^{3+}$):
Водный раствор соли имеет характерный желто-бурый цвет.
Качественной реакцией на ион $Fe^{3+}$ является взаимодействие с раствором щелочи ($NaOH$, $KOH$). При этом выпадает бурый студенистый осадок гидроксида железа(III) ($Fe(OH)_3$).
Уравнение реакции: $FeCl_3 + 3NaOH \rightarrow Fe(OH)_3\downarrow + 3NaCl$
Сокращенное ионное уравнение: $Fe^{3+} + 3OH^- \rightarrow Fe(OH)_3\downarrow$
Другой, очень чувствительной, реакцией является взаимодействие с раствором тиоцианата (роданида) калия ($KSCN$) или аммония ($NH_4SCN$). В результате образуется комплексное соединение кроваво-красного цвета.
Уравнение реакции: $FeCl_3 + 3KSCN \rightarrow Fe(SCN)_3 + 3KCl$
Сокращенное ионное уравнение: $Fe^{3+} + 3SCN^- \rightarrow Fe(SCN)_3$
2. Определение хлорид-анионов ($Cl^-$):
Проводится реакция с раствором нитрата серебра ($AgNO_3$). В результате реакции выпадает белый творожистый осадок хлорида серебра ($AgCl$).
Уравнение реакции: $FeCl_3 + 3AgNO_3 \rightarrow 3AgCl\downarrow + Fe(NO_3)_3$
Сокращенное ионное уравнение: $Ag^+ + Cl^- \rightarrow AgCl\downarrow$
Ответ: В составе хлорида железа(III) экспериментально подтверждено наличие катионов железа(III) ($Fe^{3+}$) и хлорид-анионов ($Cl^-$).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8-9 класс, для упражнения номер 8 расположенного на странице 76 для III-й части к задачнику с помощником 2009 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №8 (с. 76), авторов: Гара (Наталья Николаевна), Габрусева (Надежда Ивановна), III-й части учебного пособия издательства Просвещение.
















