Номер 8-20, страница 98 - гдз по химии 8 класс задачник Кузнецова, Левкин

Авторы: Кузнецова Н. Е., Левкин А. Н.
Тип: Задачник
Серия: алгоритм успеха
Издательство: Вентана-граф
Год издания: 2014 - 2025
Цвет обложки: бирюзовый
ISBN: 978-5-360-05720-8
Популярные ГДЗ в 8 классе
Глава 8. Водород. Галогены. 8.1. Водород - номер 8-20, страница 98.
№8-20 (с. 98)
Условие. №8-20 (с. 98)
скриншот условия

8-20. При взаимодействии 12 г некоторого металла с разбавленным раствором серной кислоты образовался 1 г водорода. В полученной соли металл двухвалентен. С каким металлом был проведен опыт?
Решение. №8-20 (с. 98)
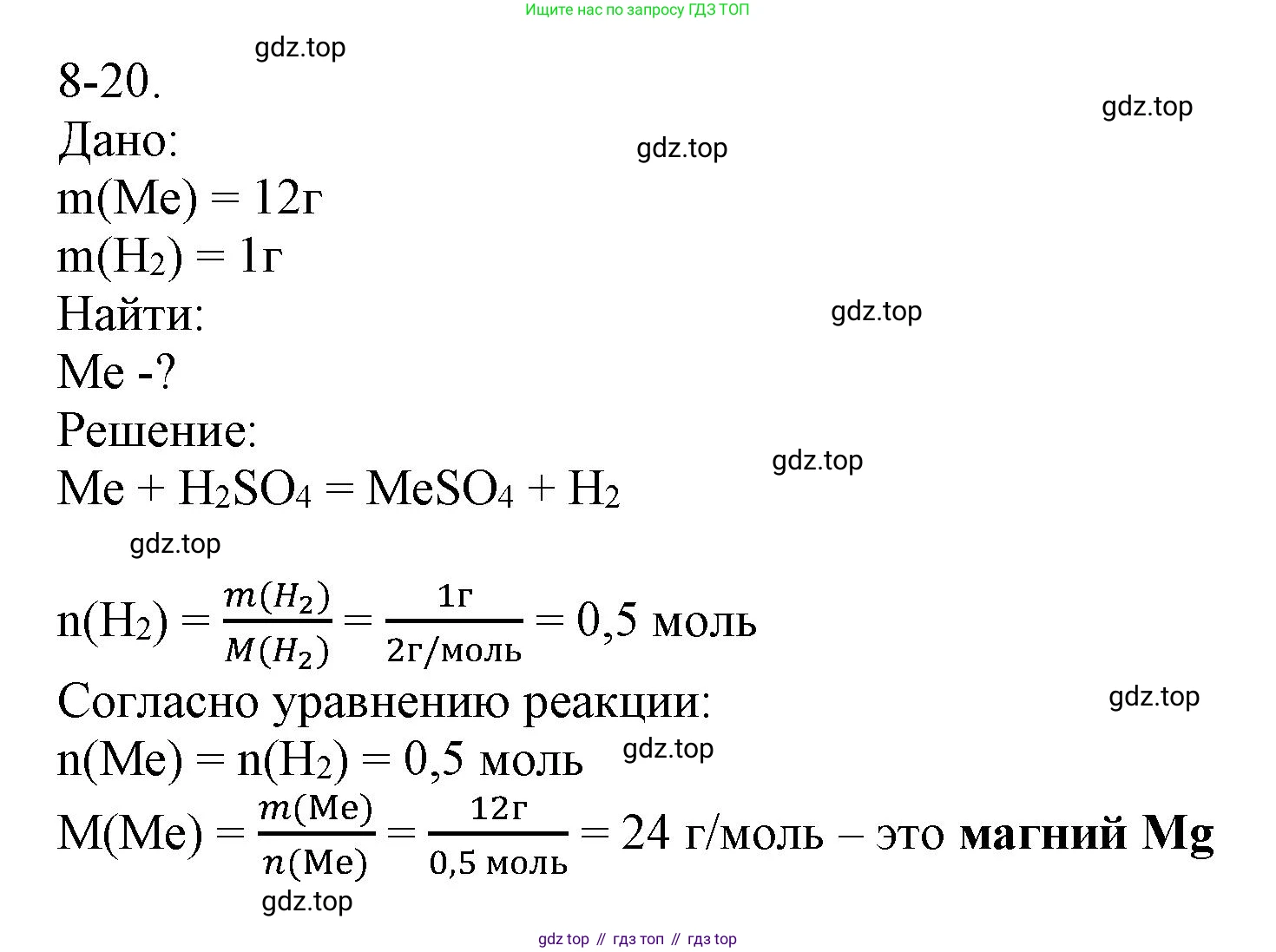
Решение 2. №8-20 (с. 98)
Дано:
Масса металла: $m(Me) = 12 \text{ г}$
Масса водорода: $m(H_2) = 1 \text{ г}$
Валентность металла = II
(Все данные представлены в единицах, удобных для химических расчетов, и не требуют перевода в СИ.)
Найти:
Неизвестный металл (Me) - ?
Решение:
1. Составим уравнение химической реакции. Обозначим неизвестный металл как Me. Поскольку металл двухвалентен, он будет образовывать с сульфат-ионом ($SO_4^{2-}$) соль состава $MeSO_4$. В реакции с разбавленной серной кислотой металл, стоящий в ряду активности до водорода, вытесняет его. Уравнение реакции выглядит следующим образом:
$Me + H_2SO_4 \rightarrow MeSO_4 + H_2 \uparrow$
Стехиометрические коэффициенты в данном уравнении равны 1.
2. Рассчитаем количество вещества (в молях) выделившегося водорода ($H_2$). Для этого нам понадобится молярная масса водорода:
$M(H_2) = 2 \cdot M(H) = 2 \cdot 1 \text{ г/моль} = 2 \text{ г/моль}$
Теперь найдем количество вещества по формуле $n = m/M$:
$n(H_2) = \frac{m(H_2)}{M(H_2)} = \frac{1 \text{ г}}{2 \text{ г/моль}} = 0.5 \text{ моль}$
3. Согласно уравнению реакции, количества вещества металла и водорода соотносятся как 1:1.
$\frac{n(Me)}{1} = \frac{n(H_2)}{1}$
Следовательно, количество вещества прореагировавшего металла также равно 0.5 моль:
$n(Me) = n(H_2) = 0.5 \text{ моль}$
4. Зная массу и количество вещества неизвестного металла, мы можем определить его молярную массу ($M$):
$M(Me) = \frac{m(Me)}{n(Me)} = \frac{12 \text{ г}}{0.5 \text{ моль}} = 24 \text{ г/моль}$
5. По значению молярной массы определим металл, обратившись к Периодической системе химических элементов Д. И. Менделеева. Элемент с относительной атомной массой, близкой к 24, – это магний (Mg) с атомной массой 24,305. Магний является металлом второй группы, главной подгруппы, и проявляет в соединениях валентность II. Он активно реагирует с разбавленной серной кислотой.
Ответ: опыт был проведен с магнием (Mg).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 8-20 расположенного на странице 98 к задачнику серии алгоритм успеха 2014 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №8-20 (с. 98), авторов: Кузнецова (Нинель Евгеньевна), Левкин (Антон Николаевич), учебного пособия издательства Вентана-граф.
















