Практическая работа №6, страница 166 - гдз по химии 9 класс учебник Габриелян, Остроумов

Авторы: Габриелян О. С., Остроумов И. Г., Сладков С. А.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-110655-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава IV. Металлы и их соединения. §32. Жёсткость воды и способы её устранения. Практическая работа - страница 166.
Практическая работа №6 (с. 166)
Условие. Практическая работа №6 (с. 166)
скриншот условия

Практическая работа 6
ЖЁСТКОСТЬ ВОДЫ И СПОСОБЫ ЕЁ УСТРАНЕНИЯ
1. Закройте пробирку пробкой с газоотводной трубкой и проверьте прибор на герметичность.
2. В прибор для получения газов внесите 2—3 небольших кусочка мрамора. Закрепите прибор в лапке штатива. В воронку налейте немного соляной кислоты, чтобы она покрывала кусочки мрамора. Что наблюдаете? Запишите уравнения реакции в молекулярной и ионной формах.
3. Газоотводную трубку прибора опустите в пробирку с прозрачной известковой водой. Что наблюдаете? Запишите уравнения реакции в молекулярной и ионной формах.
4. Продолжайте пропускание углекислого газа до получения прозрачного раствора. Запишите уравнения реакции в молекулярной и ионной формах.
Полученную жёсткую воду разделите на три пробирки.
5. К содержимому первой пробирки добавьте немного раствора мыла, закройте её пробкой и сильно встряхните. Что наблюдаете? Почему?
6. Вторую пробирку зажмите в пробиркодержателе и нагрейте на пламени спиртовки до кипения жидкости. Объясните наблюдаемое явление.
7. К содержимому третьей пробирки добавьте раствор соды. Что наблюдаете?
8. В пробирку прилейте 1—2 мл раствора хлорида кальция. Вставьте пробирку в пробиркодержатель и нагрейте содержимое пробирки. Наблюдаете ли вы какие-нибудь изменения, свидетельствующие о протекании химической реакции? Почему?
9. Установите пробирку в штатив и добавьте к содержимому 1—2 мл раствора карбоната натрия. Что наблюдаете? Запишите уравнения реакции в молекулярной и ионной формах. Оформите отчёт о работе.
Решение. Практическая работа №6 (с. 166)

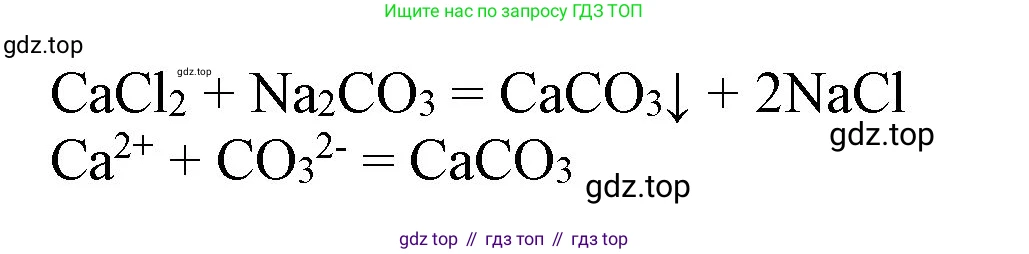
Решение 2. Практическая работа №6 (с. 166)
В прибор для получения газов внесите 2–3 небольших кусочка мрамора. Закрепите прибор в лапке штатива. В воронку налейте немного соляной кислоты, чтобы она покрывала кусочки мрамора. Что наблюдаете? Запишите уравнения реакции в молекулярной и ионной формах.
При добавлении соляной кислоты к мрамору (карбонату кальция) наблюдается бурная реакция с выделением бесцветного газа без запаха (шипение). Мрамор постепенно растворяется. Выделяющийся газ – углекислый газ ($CO_2$).
Уравнения реакции:
Молекулярное уравнение:
$CaCO_3(тв) + 2HCl(р-р) \rightarrow CaCl_2(р-р) + H_2O(ж) + CO_2(г)\uparrow$
Полное ионное уравнение:
$CaCO_3(тв) + 2H^+(р-р) + 2Cl^-(р-р) \rightarrow Ca^{2+}(р-р) + 2Cl^-(р-р) + H_2O(ж) + CO_2(г)\uparrow$
Сокращённое ионное уравнение:
$CaCO_3(тв) + 2H^+(р-р) \rightarrow Ca^{2+}(р-р) + H_2O(ж) + CO_2(г)\uparrow$
Ответ: Наблюдается выделение углекислого газа в результате реакции соляной кислоты с карбонатом кальция.
3. Газоотводную трубку прибора опустите в пробирку с прозрачной известковой водой. Что наблюдаете? Запишите уравнения реакции в молекулярной и ионной формах.
При пропускании углекислого газа через прозрачный раствор известковой воды (гидроксид кальция, $Ca(OH)_2$) наблюдается помутнение раствора из-за образования белого осадка нерастворимого карбоната кальция.
Уравнения реакции:
Молекулярное уравнение:
$CO_2(г) + Ca(OH)_2(р-р) \rightarrow CaCO_3(осадок)\downarrow + H_2O(ж)$
Полное ионное уравнение:
$CO_2(г) + Ca^{2+}(р-р) + 2OH^-(р-р) \rightarrow CaCO_3(осадок)\downarrow + H_2O(ж)$
Сокращённое ионное уравнение совпадает с полным.
Ответ: Прозрачный раствор мутнеет из-за образования нерастворимого карбоната кальция.
4. Продолжайте пропускание углекислого газа до получения прозрачного раствора. Запишите уравнения реакции в молекулярной и ионной формах.
При дальнейшем пропускании избытка углекислого газа через мутный раствор осадок карбоната кальция растворяется, и раствор снова становится прозрачным. Это происходит потому, что нерастворимый карбонат кальция реагирует с угольной кислотой (образующейся при растворении $CO_2$ в воде) с образованием растворимого гидрокарбоната кальция $Ca(HCO_3)_2$. Полученный раствор представляет собой модель воды с временной (карбонатной) жёсткостью.
Уравнения реакции:
Молекулярное уравнение:
$CaCO_3(осадок) + H_2O(ж) + CO_2(г) \rightarrow Ca(HCO_3)_2(р-р)$
Ионное уравнение:
$CaCO_3(осадок) + H_2O(ж) + CO_2(г) \rightarrow Ca^{2+}(р-р) + 2HCO_3^-(р-р)$
Ответ: Осадок растворяется с образованием растворимого гидрокарбоната кальция, который обуславливает временную жёсткость воды.
5. К содержимому первой пробирки добавьте немного раствора мыла, закройте её пробкой и сильно встряхните. Что наблюдаете? Почему?
При добавлении мыльного раствора к полученной жёсткой воде и встряхивании практически не образуется пена. Вместо этого наблюдается образование белого творожистого осадка. Это происходит потому, что ионы кальция ($Ca^{2+}$), присутствующие в жёсткой воде, взаимодействуют с анионами высших жирных кислот, входящими в состав мыла (например, со стеаратом натрия $C_{17}H_{35}COONa$), образуя нерастворимые кальциевые соли (стеарат кальция). Мыло начнёт пениться только после того, как все ионы $Ca^{2+}$ будут осаждены.
Уравнение реакции в ионной форме:
$Ca^{2+}(р-р) + 2C_{17}H_{35}COO^-(р-р) \rightarrow (C_{17}H_{35}COO)_2Ca(осадок)\downarrow$
Ответ: Мыло не пенится в жёсткой воде, так как образуются нерастворимые соли кальция и высших жирных кислот.
6. Вторую пробирку зажмите в пробиркодержателе и нагрейте на пламени спиртовки до кипения жидкости. Объясните наблюдаемое явление.
При нагревании раствора до кипения он снова мутнеет, и на дно и стенки пробирки выпадает белый осадок (накипь). Это явление объясняется термическим разложением растворимого гидрокарбоната кальция. При кипячении он распадается на нерастворимый карбонат кальция, воду и углекислый газ, который улетучивается. Таким образом, кипячение устраняет временную (карбонатную) жёсткость.
Уравнение реакции:
$Ca(HCO_3)_2(р-р) \xrightarrow{t^\circ} CaCO_3(осадок)\downarrow + H_2O(ж) + CO_2(г)\uparrow$
Ответ: Временная жёсткость устраняется кипячением, так как растворимые гидрокарбонаты разлагаются с образованием нерастворимых карбонатов (накипи).
7. К содержимому третьей пробирки добавьте раствор соды. Что наблюдаете?
При добавлении к жёсткой воде раствора кальцинированной соды (карбоната натрия, $Na_2CO_3$) наблюдается образование белого осадка. Это химический способ умягчения воды. Ионы кальция ($Ca^{2+}$) из гидрокарбоната кальция реагируют с карбонат-ионами ($CO_3^{2-}$) из соды, образуя нерастворимый карбонат кальция.
Уравнение реакции:
$Ca(HCO_3)_2(р-р) + Na_2CO_3(р-р) \rightarrow CaCO_3(осадок)\downarrow + 2NaHCO_3(р-р)$
Сокращённое ионное уравнение:
$Ca^{2+}(р-р) + CO_3^{2-}(р-р) \rightarrow CaCO_3(осадок)\downarrow$
Ответ: Добавление соды вызывает осаждение ионов кальция в виде карбоната кальция, устраняя жёсткость воды.
8. В пробирку прилейте 1–2 мл раствора хлорида кальция. Вставьте пробирку в пробиркодержатель и нагрейте содержимое пробирки. Наблюдаете ли вы какие-нибудь изменения, свидетельствующие о протекании химической реакции? Почему?
При нагревании раствора хлорида кальция ($CaCl_2$), который является моделью воды с постоянной (некарбонатной) жёсткостью, никаких видимых изменений не происходит. Раствор остаётся прозрачным, осадок не образуется. Это происходит потому, что соли, вызывающие постоянную жёсткость (хлориды и сульфаты кальция и магния), являются термически устойчивыми и не разлагаются при кипячении. Следовательно, кипячением устранить постоянную жёсткость невозможно.
Ответ: Изменений нет, так как постоянная жёсткость, в отличие от временной, не устраняется кипячением.
9. Установите пробирку в штатив и добавьте к содержимому 1–2 мл раствора карбоната натрия. Что наблюдаете? Запишите уравнения реакции в молекулярной и ионной формах.
При добавлении раствора карбоната натрия ($Na_2CO_3$) к раствору хлорида кальция (вода с постоянной жёсткостью) немедленно выпадает белый осадок карбоната кальция. Этот метод позволяет устранить и постоянную жёсткость.
Уравнения реакции:
Молекулярное уравнение:
$CaCl_2(р-р) + Na_2CO_3(р-р) \rightarrow CaCO_3(осадок)\downarrow + 2NaCl(р-р)$
Полное ионное уравнение:
$Ca^{2+}(р-р) + 2Cl^-(р-р) + 2Na^+(р-р) + CO_3^{2-}(р-р) \rightarrow CaCO_3(осадок)\downarrow + 2Na^+(р-р) + 2Cl^-(р-р)$
Сокращённое ионное уравнение:
$Ca^{2+}(р-р) + CO_3^{2-}(р-р) \rightarrow CaCO_3(осадок)\downarrow$
Ответ: Постоянную жёсткость можно устранить химически, добавив соду, которая осаждает ионы кальция из раствора.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения Практическая работа №6 расположенного на странице 166 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Практическая работа №6 (с. 166), авторов: Габриелян (Олег Саргисович), Остроумов (Игорь Геннадьевич), Сладков (Сергей Анатольевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















