Номер 5, страница 25 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава II. Химические реакции в водных растворах. §6. Химические свойства кислот как электролитов. Часть 1 - номер 5, страница 25.
№5 (с. 25)
Условие. №5 (с. 25)
скриншот условия


5. Кислоты взаимодействуют с солями, если образуется газ ($\uparrow$) или осадок ($\downarrow$).
Дано сокращённое ионное уравнение:
$CaCO_3 + 2^{\text{[ ]}}\text{[ ]} = \text{[ ]} + \text{[ ]}\uparrow + \text{[ ]}$
Составьте соответствующие молекулярные уравнения:
a) ____________________________________________________________________________________________________
б) ____________________________________________________________________________________________________
Дано сокращённое ионное уравнение: $\text{SiO}_3^{2-} + 2\text{[ ]} = \text{[ ]}\downarrow$
Составьте соответствующие молекулярные уравнения:
a) ____________________________________________________________________________________________________
б) ____________________________________________________________________________________________________
6. Химические свойства солей
Дано сокращённое ионное уравнение: $\text{Ba}^{2+} + \text{SO}_4^{2-} = \text{[ ]}\downarrow$
Составьте соответствующие молекулярные уравнения:
a) ____________________________________________________________________________________________________
б) ____________________________________________________________________________________________________
Решение. №5 (с. 25)
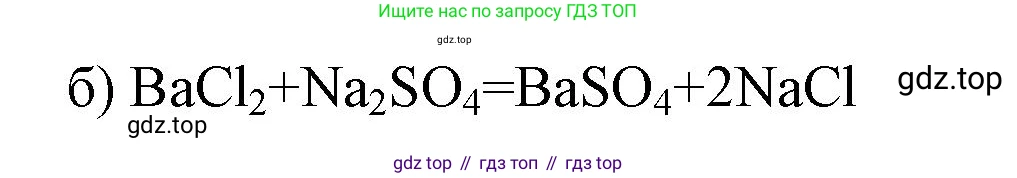
Решение 2. №5 (с. 25)
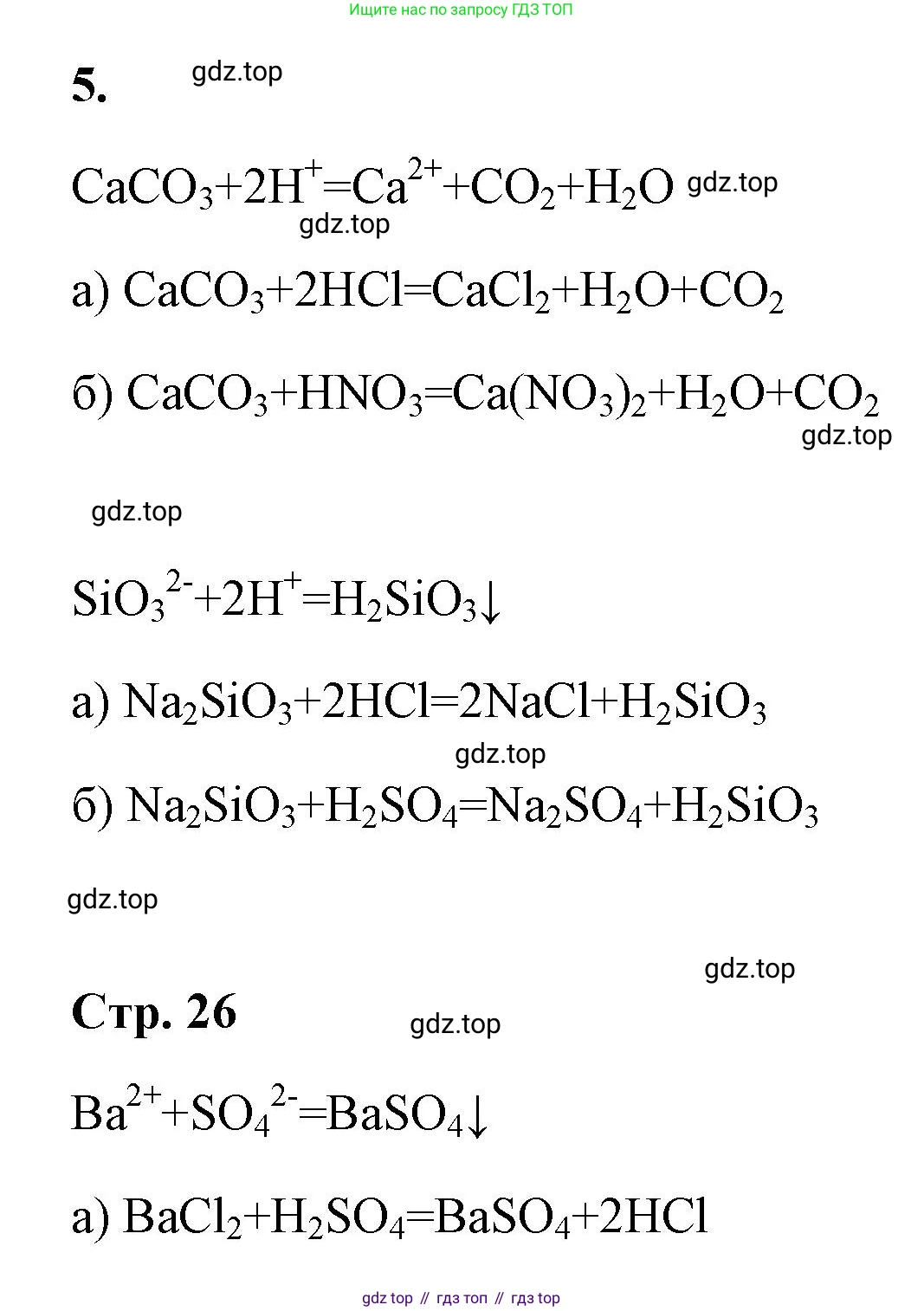
1. Дано сокращённое ионное уравнение: $CaCO_3 + 2\text{__} = \text{__} + \text{__} \uparrow + \text{__}$
Решение:
Это реакция ионного обмена между нерастворимой солью (карбонатом кальция) и сильной кислотой. Признаком реакции является выделение газа. Карбонаты при взаимодействии с кислотами разлагаются с образованием соли, воды и углекислого газа. Ионы водорода ($H^+$) из кислоты реагируют с карбонат-ионом ($CO_3^{2-}$) из $CaCO_3$. Так как $CaCO_3$ — нерастворимое вещество, в ионном уравнении оно записывается в молекулярном виде.
Заполним пропуски в уравнении: $CaCO_3 + 2H^+ = Ca^{2+} + CO_2 \uparrow + H_2O$.
Составьте соответствующие молекулярные уравнения:
а) Для составления молекулярного уравнения в качестве источника ионов $H^+$ возьмем сильную кислоту, например, соляную ($HCl$). Ионы $Ca^{2+}$ и $Cl^-$ образуют растворимую соль хлорид кальция ($CaCl_2$).
Молекулярное уравнение: $CaCO_3 + 2HCl = CaCl_2 + CO_2 \uparrow + H_2O$.
Полное ионное уравнение: $CaCO_3(тв) + 2H^+ + 2Cl^- = Ca^{2+} + 2Cl^- + CO_2 \uparrow + H_2O$.
После сокращения ионов-наблюдателей ($2Cl^-$) получаем исходное сокращенное ионное уравнение.
Ответ: $CaCO_3 + 2HCl = CaCl_2 + CO_2 \uparrow + H_2O$.
б) В качестве другой сильной кислоты можно использовать азотную кислоту ($HNO_3$). Ионы $Ca^{2+}$ и $NO_3^-$ образуют растворимую соль нитрат кальция ($Ca(NO_3)_2$).
Молекулярное уравнение: $CaCO_3 + 2HNO_3 = Ca(NO_3)_2 + CO_2 \uparrow + H_2O$.
Полное ионное уравнение: $CaCO_3(тв) + 2H^+ + 2NO_3^- = Ca^{2+} + 2NO_3^- + CO_2 \uparrow + H_2O$.
После сокращения ионов-наблюдателей ($2NO_3^-$) получаем исходное сокращенное ионное уравнение.
Ответ: $CaCO_3 + 2HNO_3 = Ca(NO_3)_2 + CO_2 \uparrow + H_2O$.
2. Дано сокращённое ионное уравнение: $SiO_3^{2-} + 2\text{__} = \text{__} \downarrow$
Решение:
Это реакция ионного обмена, в которой силикат-ион ($SiO_3^{2-}$) реагирует с ионами водорода ($H^+$), образуя нерастворимую кремниевую кислоту ($H_2SiO_3$), которая выпадает в виде гелеобразного осадка. Исходными веществами должны быть растворимый силикат и сильная кислота.
Заполним пропуски в уравнении: $SiO_3^{2-} + 2H^+ = H_2SiO_3 \downarrow$.
Составьте соответствующие молекулярные уравнения:
а) В качестве источника силикат-ионов возьмем силикат натрия ($Na_2SiO_3$), а в качестве кислоты — соляную кислоту ($HCl$).
Молекулярное уравнение: $Na_2SiO_3 + 2HCl = H_2SiO_3 \downarrow + 2NaCl$.
Полное ионное уравнение: $2Na^+ + SiO_3^{2-} + 2H^+ + 2Cl^- = H_2SiO_3 \downarrow + 2Na^+ + 2Cl^-$.
Ионы-наблюдатели — $Na^+$ и $Cl^-$.
Ответ: $Na_2SiO_3 + 2HCl = H_2SiO_3 \downarrow + 2NaCl$.
б) В качестве другого примера возьмем силикат калия ($K_2SiO_3$) и серную кислоту ($H_2SO_4$).
Молекулярное уравнение: $K_2SiO_3 + H_2SO_4 = H_2SiO_3 \downarrow + K_2SO_4$.
Полное ионное уравнение: $2K^+ + SiO_3^{2-} + 2H^+ + SO_4^{2-} = H_2SiO_3 \downarrow + 2K^+ + SO_4^{2-}$.
Ионы-наблюдатели — $K^+$ и $SO_4^{2-}$.
Ответ: $K_2SiO_3 + H_2SO_4 = H_2SiO_3 \downarrow + K_2SO_4$.
3. Дано сокращённое ионное уравнение: $Ba^{2+} + SO_4^{2-} = \text{__} \downarrow$
Решение:
Это качественная реакция на ионы бария ($Ba^{2+}$) и сульфат-ионы ($SO_4^{2-}$). При их взаимодействии образуется нерастворимый в воде и кислотах белый осадок сульфата бария ($BaSO_4$). Для реакции нужно взять растворимую соль бария и растворимый сульфат (или серную кислоту).
Заполним пропуск в уравнении: $Ba^{2+} + SO_4^{2-} = BaSO_4 \downarrow$.
Составьте соответствующие молекулярные уравнения:
а) Возьмем растворимую соль бария, например, хлорид бария ($BaCl_2$), и растворимый сульфат, например, сульфат калия ($K_2SO_4$).
Молекулярное уравнение: $BaCl_2 + K_2SO_4 = BaSO_4 \downarrow + 2KCl$.
Полное ионное уравнение: $Ba^{2+} + 2Cl^- + 2K^+ + SO_4^{2-} = BaSO_4 \downarrow + 2K^+ + 2Cl^-$.
Ионы-наблюдатели — $K^+$ и $Cl^-$.
Ответ: $BaCl_2 + K_2SO_4 = BaSO_4 \downarrow + 2KCl$.
б) В качестве другого примера можно взять нитрат бария ($Ba(NO_3)_2$) и серную кислоту ($H_2SO_4$).
Молекулярное уравнение: $Ba(NO_3)_2 + H_2SO_4 = BaSO_4 \downarrow + 2HNO_3$.
Полное ионное уравнение: $Ba^{2+} + 2NO_3^- + 2H^+ + SO_4^{2-} = BaSO_4 \downarrow + 2H^+ + 2NO_3^-$.
Ионы-наблюдатели — $H^+$ и $NO_3^-$.
Ответ: $Ba(NO_3)_2 + H_2SO_4 = BaSO_4 \downarrow + 2HNO_3$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 5 расположенного на странице 25 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 25), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















