Номер 1, страница 26 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава II. Химические реакции в водных растворах. §6. Химические свойства кислот как электролитов. Часть 2 - номер 1, страница 26.
№1 (с. 26)
Условие. №1 (с. 26)
скриншот условия


Часть II
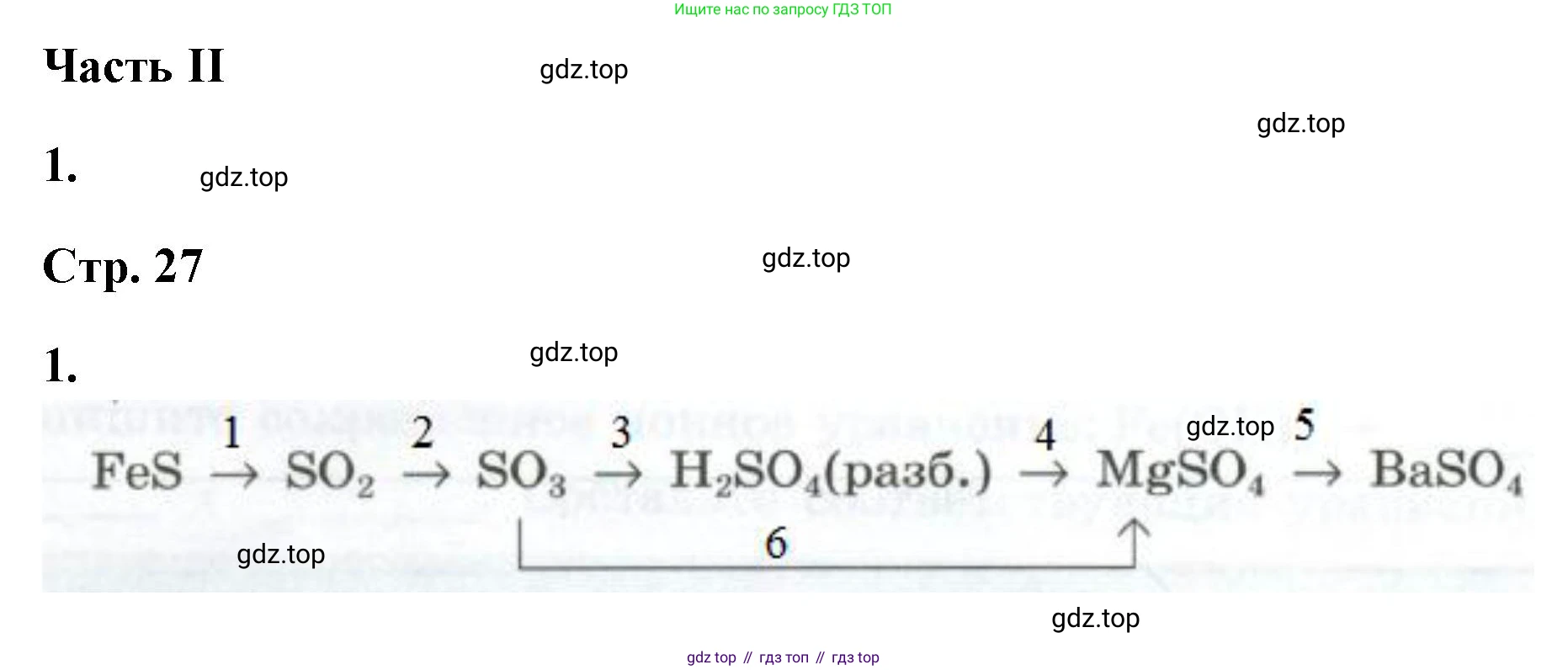
1. Запишите уравнения реакций, соответствующих следующим превращениям:
$FeS \to SO_2 \to SO_3 \to H_2SO_4(разб.) \to MgSO_4 \to BaSO_4$
2. Для окислительно-восстановительных реакций напишите электронный баланс, а для реакций с участием электролитов — полные и сокращённые ионные уравнения.
1)
2)
3)
4)
5)
6) (А) $CO + H_2S = CO_2 + H_2O$
(Б) $Cl_2 + Ba = BaCl_2$
7) (В) $CaCO_3 + HCl$
(Г) $CO + HNO_3$
Решение. №1 (с. 26)

Решение 2. №1 (с. 26)
1) Превращение сульфида железа(II) в оксид серы(IV) — это обжиг сульфида в кислороде. Данная реакция является окислительно-восстановительной (ОВР).
Молекулярное уравнение реакции:
$4FeS + 7O_2 \xrightarrow{t} 2Fe_2O_3 + 4SO_2$
Электронный баланс:
$4 | Fe^{+2}S^{-2} - 7e^- \rightarrow Fe^{+3} + S^{+4}$ (Процесс окисления, FeS - восстановитель)
$7 | O_2^0 + 4e^- \rightarrow 2O^{-2}$ (Процесс восстановления, $O_2$ - окислитель)
Ответ: $4FeS + 7O_2 \xrightarrow{t} 2Fe_2O_3 + 4SO_2$
2) Превращение оксида серы(IV) в оксид серы(VI) — это каталитическое окисление кислородом. Это также ОВР.
Молекулярное уравнение реакции:
$2SO_2 + O_2 \xrightarrow{V_2O_5, t} 2SO_3$
Электронный баланс:
$2 | S^{+4} - 2e^- \rightarrow S^{+6}$ (Процесс окисления, $SO_2$ - восстановитель)
$1 | O_2^0 + 4e^- \rightarrow 2O^{-2}$ (Процесс восстановления, $O_2$ - окислитель)
Ответ: $2SO_2 + O_2 \xrightarrow{V_2O_5, t} 2SO_3$
3) Получение серной кислоты из оксида серы(VI). В промышленности этот процесс обычно проводят в две стадии, чтобы избежать образования кислотного тумана. Сначала оксид серы(VI) поглощают концентрированной серной кислотой с образованием олеума.
Молекулярное уравнение реакции:
$SO_3 + H_2SO_4 (конц.) \rightarrow H_2S_2O_7$
Ответ: $SO_3 + H_2SO_4 (конц.) \rightarrow H_2S_2O_7$
4) Вторая стадия получения серной кислоты — разбавление олеума водой.
Молекулярное уравнение реакции:
$H_2S_2O_7 + H_2O \rightarrow 2H_2SO_4$
Ответ: $H_2S_2O_7 + H_2O \rightarrow 2H_2SO_4$
5) Получение сульфата магния из разбавленной серной кислоты. Это можно сделать, проведя реакцию с оксидом, гидроксидом или карбонатом магния. Возьмём реакцию с гидроксидом магния, которая является реакцией ионного обмена (нейтрализации).
Молекулярное уравнение:
$H_2SO_4 + Mg(OH)_2 \rightarrow MgSO_4 + 2H_2O$
Полное ионное уравнение (учитывая, что $Mg(OH)_2$ - малорастворимое основание):
$2H^+ + SO_4^{2-} + Mg(OH)_2(тв.) \rightarrow Mg^{2+} + SO_4^{2-} + 2H_2O$
Сокращённое ионное уравнение:
$2H^+ + Mg(OH)_2(тв.) \rightarrow Mg^{2+} + 2H_2O$
Ответ: $H_2SO_4 + Mg(OH)_2 \rightarrow MgSO_4 + 2H_2O$
6) Получение сульфата бария из сульфата магния. Это качественная реакция на сульфат-ион, проводимая с помощью растворимой соли бария (например, хлорида бария). Выпадает белый осадок сульфата бария. Это реакция ионного обмена.
Молекулярное уравнение:
$MgSO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + MgCl_2$
Полное ионное уравнение:
$Mg^{2+} + SO_4^{2-} + Ba^{2+} + 2Cl^- \rightarrow BaSO_4\downarrow + Mg^{2+} + 2Cl^-$
Сокращённое ионное уравнение:
$Ba^{2+} + SO_4^{2-} \rightarrow BaSO_4\downarrow$
Ответ: $MgSO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + MgCl_2$
7) Альтернативный способ получения сульфата магния, указанный в схеме (переход от $SO_3$ к $MgSO_4$). Это реакция кислотного оксида с основным оксидом.
Молекулярное уравнение реакции:
$SO_3 + MgO \rightarrow MgSO_4$
Ответ: $SO_3 + MgO \rightarrow MgSO_4$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 1 расположенного на странице 26 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 26), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















