Номер 5, страница 66 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §16. Общая характеристика химических элементов VА - группы. Азот. Часть 1 - номер 5, страница 66.
№5 (с. 66)
Условие. №5 (с. 66)
скриншот условия
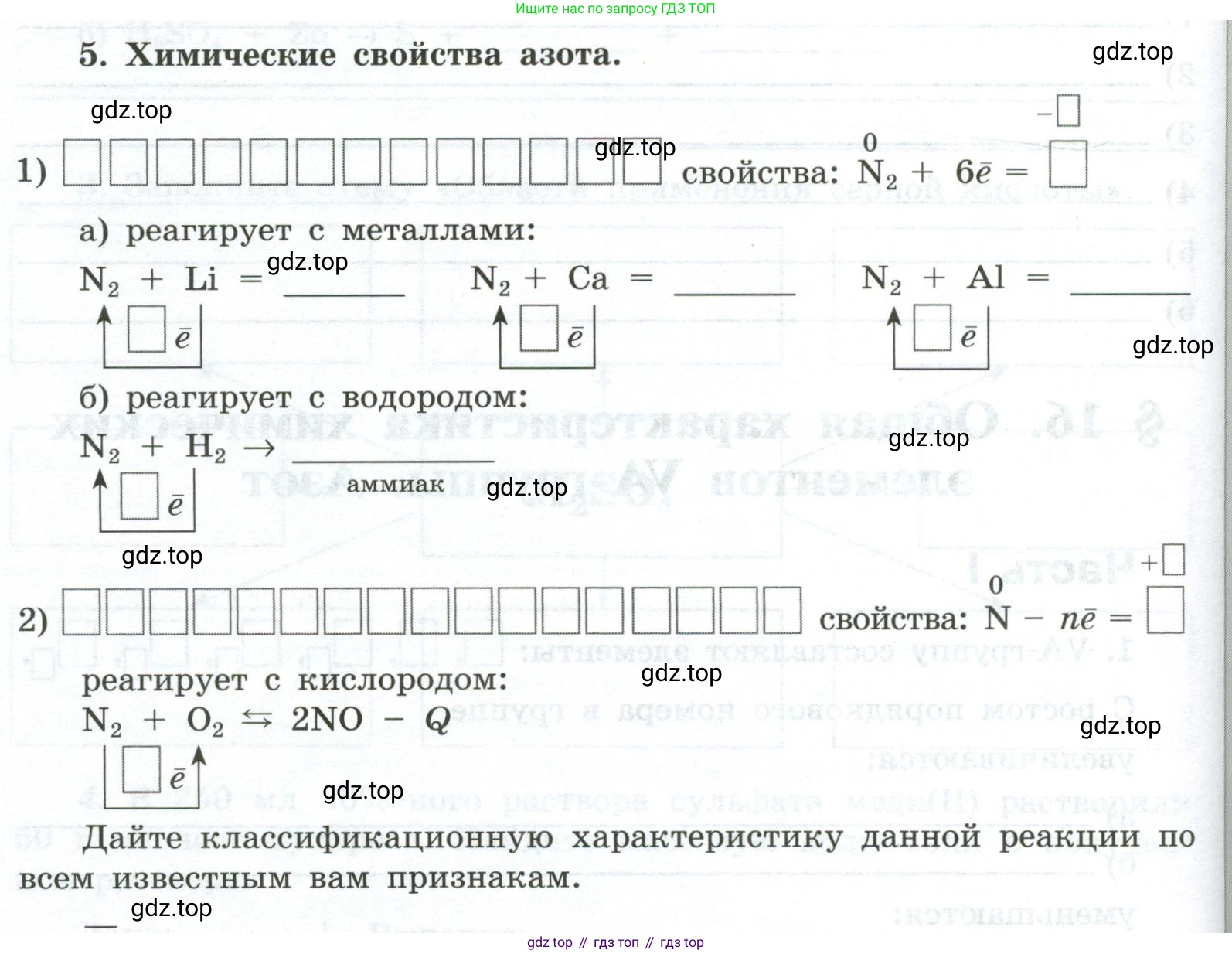
5. Химические свойства азота.
1) свойства: $N_2^0 + 6\bar{e} = []$
а) реагирует с металлами:
$N_2 + Li = \text{______}$
$N_2 + Ca = \text{______}$
$N_2 + Al = \text{______}$
б) реагирует с водородом:
$N_2 + H_2 \rightarrow \text{______}$ аммиак
2) свойства: $N^0 - n\bar{e} = []$
реагирует с кислородом:
$N_2 + O_2 \rightleftarrows 2NO - Q$
Дайте классификационную характеристику данной реакции по всем известным вам признакам.
Решение. №5 (с. 66)


Решение 2. №5 (с. 66)
1) Окислительные свойства
Решение
В пустые клетки заголовка следует вписать слово "Окислительные". Азот проявляет окислительные свойства в реакциях с менее электроотрицательными элементами (металлами, водородом), принимая электроны. При этом его степень окисления понижается с 0 до -3. Процесс восстановления молекулярного азота можно описать полуреакцией, в которой молекула $N_2$ принимает 6 электронов, образуя два нитрид-иона:
$N_2^0 + 6\bar{e} = 2N^{-3}$
а) реагирует с металлами:
При взаимодействии с активными металлами азот выступает как окислитель, образуя соли — нитриды. Во всех этих реакциях молекула азота $N_2$ принимает 6 электронов.
С литием: $N_2 + 6Li = 2Li_3N$ (нитрид лития)
С кальцием: $N_2 + 3Ca = Ca_3N_2$ (нитрид кальция)
С алюминием: $N_2 + 2Al = 2AlN$ (нитрид алюминия)
б) реагирует с водородом:
При взаимодействии с водородом азот также является окислителем. В результате обратимой реакции образуется аммиак. Молекула азота $N_2$ принимает 6 электронов.
$N_2 + 3H_2 \rightleftharpoons 2NH_3$ (аммиак)
Ответ: В пустые клетки в заголовке 1) вписывается слово "Окислительные". В полуреакции $N_2^0 + 6\bar{e} = \square N^{-\square}$ в первый квадрат вписывается "2", во второй "3". Во всех схемах электронного переноса под пунктами а) и б) в квадрат следует вписать число "6". Уравнения реакций: $N_2 + 6Li = 2Li_3N$; $N_2 + 3Ca = Ca_3N_2$; $N_2 + 2Al = 2AlN$; $N_2 + 3H_2 \rightleftharpoons 2NH_3$.
2) Восстановительные свойства
Решение
В пустые клетки заголовка следует вписать слово "Восстановительные". Азот проявляет восстановительные свойства в реакциях с более электроотрицательными элементами (например, с кислородом), отдавая электроны. При этом его степень окисления повышается. В реакции с кислородом степень окисления азота меняется с 0 до +2. Процесс окисления одного атома азота можно описать полуреакцией:
$N^0 - 2\bar{e} = N^{+2}$
реагирует с кислородом:
Реакция азота с кислородом протекает при высокой температуре (в электрической дуге) и является обратимой. Азот выступает в роли восстановителя.
$N_2 + O_2 \rightleftharpoons 2NO - Q$
В этой реакции молекула азота $N_2$ отдает 4 электрона, так как состоит из двух атомов, каждый из которых отдает по 2 электрона.
Схема окисления для молекулы: $N_2^0 - 4\bar{e} \rightarrow 2N^{+2}$
Дайте классификационную характеристику данной реакции по всем известным вам признакам.
Классификация реакции $N_2 + O_2 \rightleftharpoons 2NO - Q$:
1. По числу и составу веществ: реакция соединения (из двух простых веществ образуется одно сложное).
2. По изменению степеней окисления: окислительно-восстановительная (азот $N_2^0 \rightarrow N^{+2}$ — восстановитель, окисляется; кислород $O_2^0 \rightarrow O^{-2}$ — окислитель, восстанавливается).
3. По тепловому эффекту: эндотермическая (протекает с поглощением тепла, на что указывает "- Q").
4. По направлению: обратимая (протекает в прямом и обратном направлениях, знак $\rightleftharpoons$).
5. По участию катализатора: некаталитическая (катализатор не требуется).
6. По фазовому состоянию: гомогенная (все вещества находятся в одной фазе — газообразной).
Ответ: В пустые клетки в заголовке 2) вписывается слово "Восстановительные". В полуреакции $N^0 - n\bar{e} = N^{+\square}$ в квадрат вместо $n$ вписывается "2", а в квадрат для степени окисления — "2". В схеме электронного переноса под уравнением реакции с кислородом в квадрат вписывается число "4". Классификация реакции: реакция соединения, окислительно-восстановительная, эндотермическая, обратимая, некаталитическая, гомогенная.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 5 расположенного на странице 66 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 66), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















