Номер 1, страница 68 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §17. Аммиак. Часть 1 - номер 1, страница 68.
№1 (с. 68)
Условие. №1 (с. 68)
скриншот условия
Часть I
1. Молекулярная формула аммиака .
а) Электронная формула аммиака:
б) Структурная формула аммиака:
Геометрическая форма молекулы с обозначением атомов и частичных зарядов:
Решение. №1 (с. 68)

Решение 2. №1 (с. 68)
1. Молекулярная формула аммиака $NH_3$
а) Электронная формула аммиака:
Электронная формула, также известная как формула Льюиса, отображает распределение валентных электронов в молекуле. Атом азота (N), элемент 15-й группы, имеет 5 валентных электронов. Атом водорода (H) имеет 1 валентный электрон. В молекуле аммиака ($NH_3$) атом азота образует три одинарные ковалентные связи с тремя атомами водорода. Для этого используются 3 электрона азота и по одному электрону от каждого из трех атомов водорода. Оставшиеся 2 валентных электрона азота образуют неподеленную (свободную) электронную пару. В результате атом азота имеет завершенный электронный октет (8 электронов), а каждый атом водорода — завершенный дублет (2 электрона).
Ответ: Электронная формула аммиака, где черточки обозначают связывающие электронные пары, а точки — неподеленную электронную пару: $$ \Large \begin{array}{c} \cdot\cdot \\ \text{H}-\text{N}-\text{H} \\ | \\ \text{H} \end{array} $$
б) Структурная формула аммиака:
Структурная формула показывает порядок соединения атомов в молекуле. Ковалентные связи между атомами изображаются в виде черточек. Для аммиака она показывает, что центральный атом азота соединен с тремя атомами водорода. Часто в структурной формуле также указывают неподеленные электронные пары, так как они важны для понимания геометрии и реакционной способности молекулы.
Ответ: Структурная формула аммиака (с указанием неподеленной электронной пары): $$ \Large \begin{array}{c} \cdot\cdot \\ \text{H}-\text{N}-\text{H} \\ | \\ \text{H} \end{array} $$ Или в упрощенном виде (без указания неподеленной пары): $$ \Large \begin{array}{c} \text{H}-\text{N}-\text{H} \\ | \\ \text{H} \end{array} $$
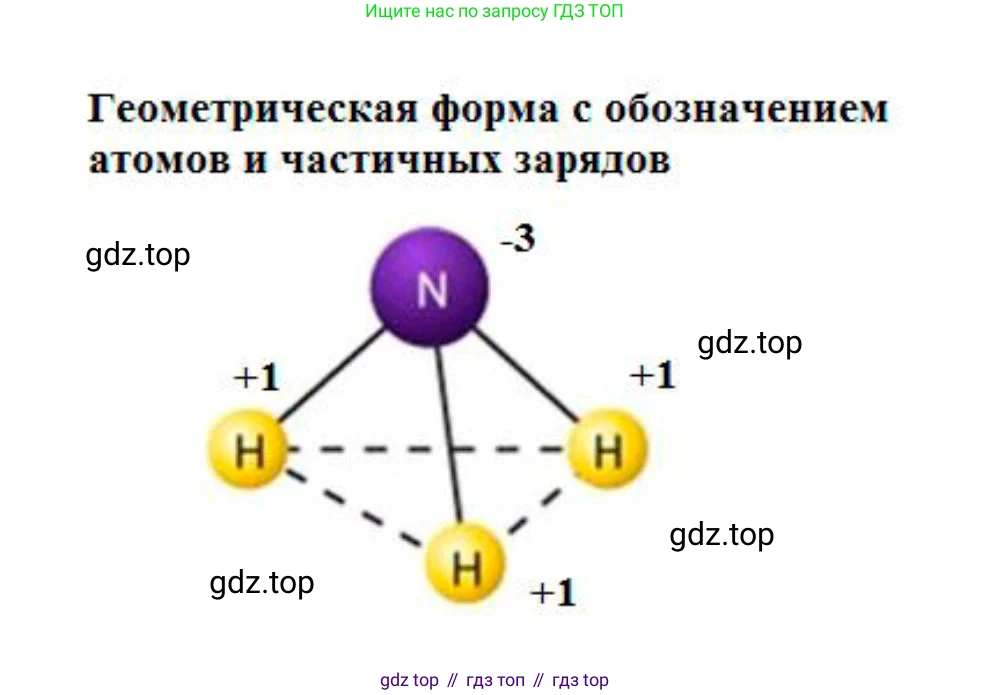
Геометрическая форма молекулы с обозначением атомов и частичных зарядов:
Геометрическая форма молекулы определяется взаимным отталкиванием электронных пар валентной оболочки центрального атома (теория VSEPR). В молекуле аммиака у центрального атома азота имеется четыре электронные пары: три связывающие (с атомами водорода) и одна неподеленная. Эти четыре пары располагаются в пространстве, образуя тетраэдрическую электронную геометрию. Однако форма самой молекулы определяется положением атомных ядер, поэтому она является тригональной (треугольной) пирамидой. Атом азота находится в вершине этой пирамиды, а три атома водорода образуют ее основание. Неподеленная пара электронов отталкивается сильнее связывающих пар, что приводит к уменьшению валентного угла H-N-H до $107,8^\circ$ (вместо идеального тетраэдрического угла $109,5^\circ$).
Связи N-H полярны из-за разницы в электроотрицательности между азотом (ЭО = 3.04) и водородом (ЭО = 2.20). Электронная плотность смещена к более электроотрицательному атому азота, в результате чего на нем возникает частичный отрицательный заряд ($\delta-$), а на каждом из атомов водорода — частичный положительный заряд ($\delta+$). Асимметричное строение молекулы и полярность связей делают молекулу аммиака в целом полярной.
Ответ: Геометрическая форма — тригональная пирамида. Ниже приведена структурная формула с обозначением атомов и частичных зарядов, которая, однако, является плоской проекцией и не передает реального пространственного строения молекулы: $$ \Large \begin{array}{c} \cdot\cdot \\ \text{H}^{\delta+}-\text{N}^{\delta-}-\text{H}^{\delta+} \\ | \\ \text{H}^{\delta+} \end{array} $$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 1 расположенного на странице 68 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 68), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















