Номер 1, страница 70 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §17. Аммиак. Часть 2 - номер 1, страница 70.
№1 (с. 70)
Условие. №1 (с. 70)
скриншот условия
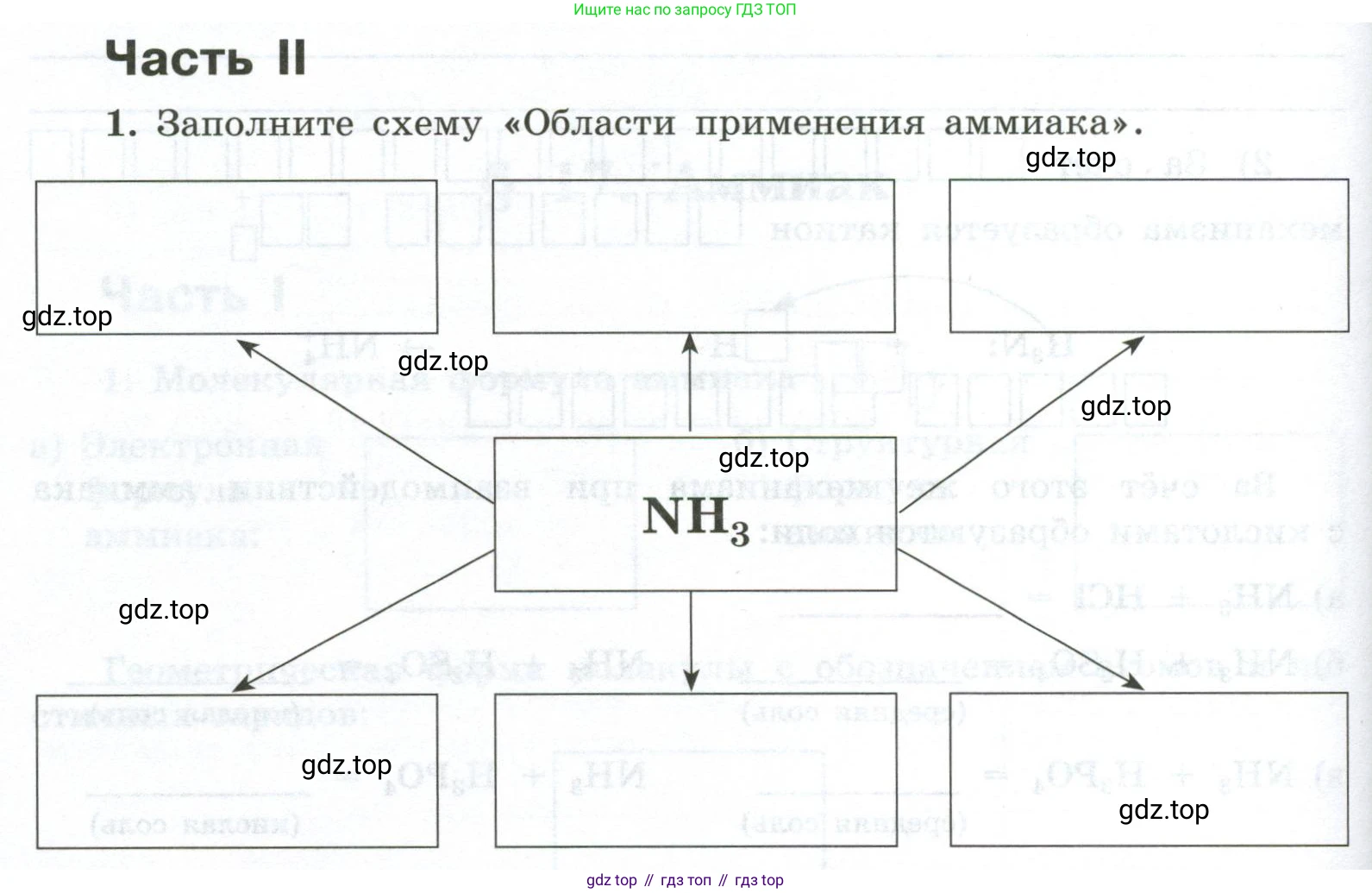
Часть II
1. Заполните схему «Области применения аммиака».
$NH_3$
$NH_3 + HCl \rightarrow NH_4Cl$
$NH_3 + H_2O \rightleftharpoons NH_4^+ + OH^-$
(слабо осн. раствор)
$NH_3 + HNO_3 \rightarrow NH_4NO_3$
(азотное удобрение)
$ = O, H_3PO_4 + NH_3$
Решение. №1 (с. 70)
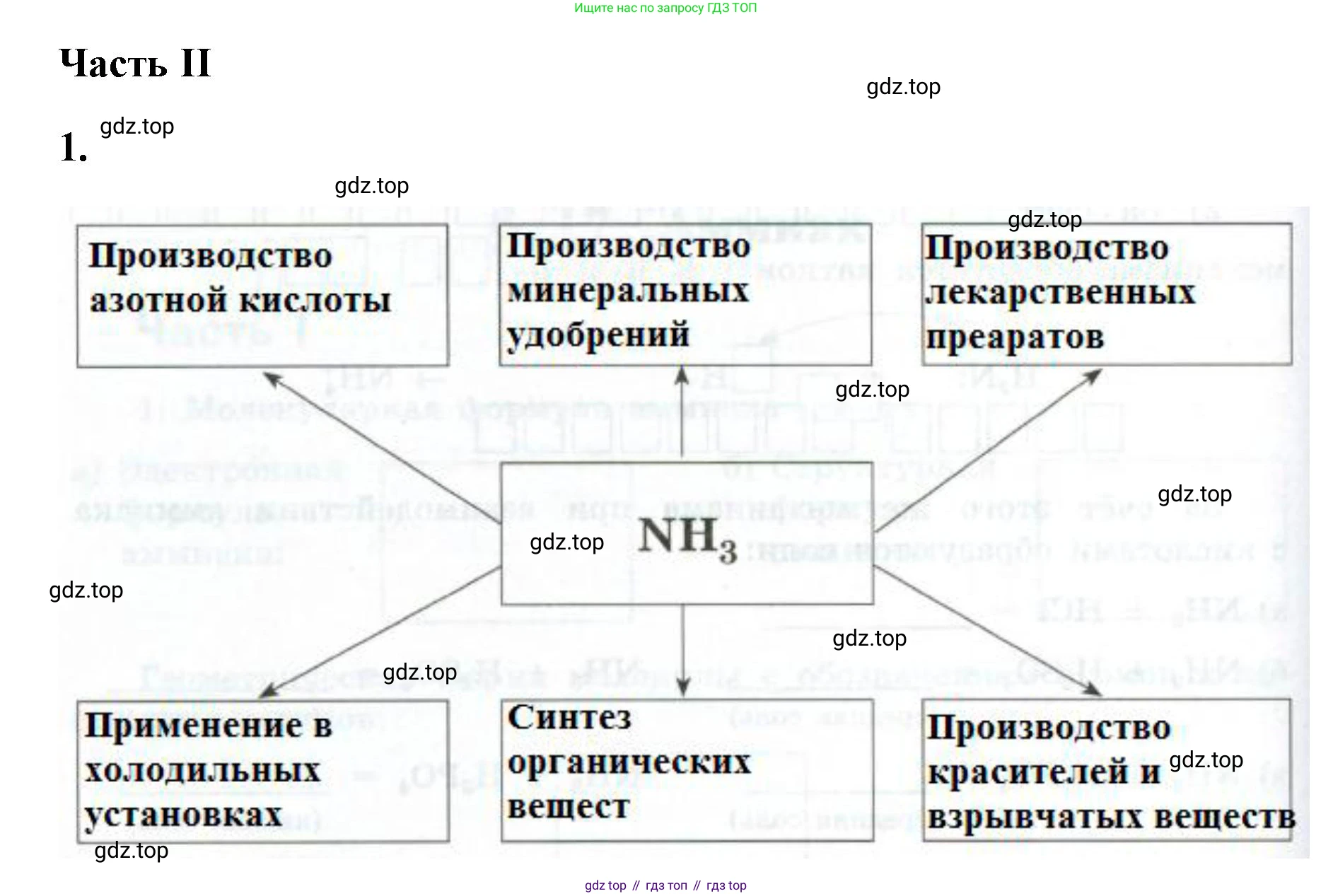
Решение 2. №1 (с. 70)
Производство азотных удобрений
Основная масса производимого в мире аммиака (более 80%) используется для производства азотных удобрений. Азот является ключевым элементом для роста и развития растений. К таким удобрениям относятся аммиачная селитра ($NH_4NO_3$), сульфат аммония ($(NH_4)_2SO_4$), мочевина (карбамид, $CO(NH_2)_2$), а также фосфаты аммония. Последние получают реакцией аммиака с фосфорной кислотой, например: $2NH_3 + H_3PO_4 \rightarrow (NH_4)_2HPO_4$. Также в качестве удобрения используют и сам сжиженный аммиак или его водный раствор (аммиачную воду).
Ответ: Производство азотных удобрений.
Производство азотной кислоты ($HNO_3$)
Аммиак является сырьем для получения азотной кислоты в промышленности по методу Оствальда. Первой и важнейшей стадией этого процесса является каталитическое окисление аммиака на платино-родиевых катализаторах при высокой температуре. Уравнение этой реакции: $4NH_3 + 5O_2 \xrightarrow{Pt/Rh, t} 4NO + 6H_2O$. Полученная азотная кислота используется для производства удобрений, взрывчатых веществ, полимеров и красителей.
Ответ: Производство азотной кислоты.
Производство соды
Аммиак играет важную роль в аммиачном методе производства кальцинированной соды ($Na_2CO_3$) по методу Сольве. Через охлажденный рассол (раствор хлорида натрия $NaCl$), насыщенный аммиаком, пропускают диоксид углерода ($CO_2$). Аммиак повышает pH раствора, что способствует реакции и осаждению малорастворимого гидрокарбоната натрия: $NaCl + NH_3 + CO_2 + H_2O \rightarrow NaHCO_3 \downarrow + NH_4Cl$. Аммиак в этом процессе регенерируется и используется повторно.
Ответ: Производство соды.
Применение в качестве хладагента
Жидкий аммиак обладает высокой теплотой испарения, что делает его очень эффективным хладагентом (хладагент R-717). Благодаря этому свойству он широко применяется в крупных промышленных холодильных установках, например, на пищевых производствах, складах, пивоваренных заводах и ледовых аренах.
Ответ: Хладагент в промышленных холодильных установках.
Производство полимеров, красителей и взрывчатых веществ
Аммиак служит исходным веществом для синтеза многих важных химических продуктов. Он используется в производстве полиамидных пластмасс и волокон, таких как капрон и нейлон. Из аммиака получают синильную кислоту ($HCN$), необходимую для производства оргстекла. Кроме того, аммиак (часто через азотную кислоту) является основой для синтеза многих взрывчатых веществ и красителей.
Ответ: Производство полимеров, красителей, взрывчатых веществ.
Применение в медицине и быту
10%-ный водный раствор аммиака известен как нашатырный спирт. Его резкий запах используется для стимуляции дыхания и выведения человека из обморочного состояния. Также аммиак в виде водных растворов (аммиачная вода) является компонентом многих бытовых чистящих средств для мытья стекол, кафеля и других поверхностей. Кроме того, соли аммония, например хлорид аммония ($NH_4Cl$), применяют в качестве флюса при пайке и в сухих гальванических элементах.
Ответ: Медицина (нашатырный спирт) и бытовая химия.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 1 расположенного на странице 70 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №1 (с. 70), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















