Номер 2, страница 70 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §17. Аммиак. Часть 2 - номер 2, страница 70.
№2 (с. 70)
Условие. №2 (с. 70)
скриншот условия

2. Закончите уравнение реакции. Расставьте коэффициенты
с помощью метода электронного баланса.
$NH_3$ + $CuO$ =
Решение. №2 (с. 70)
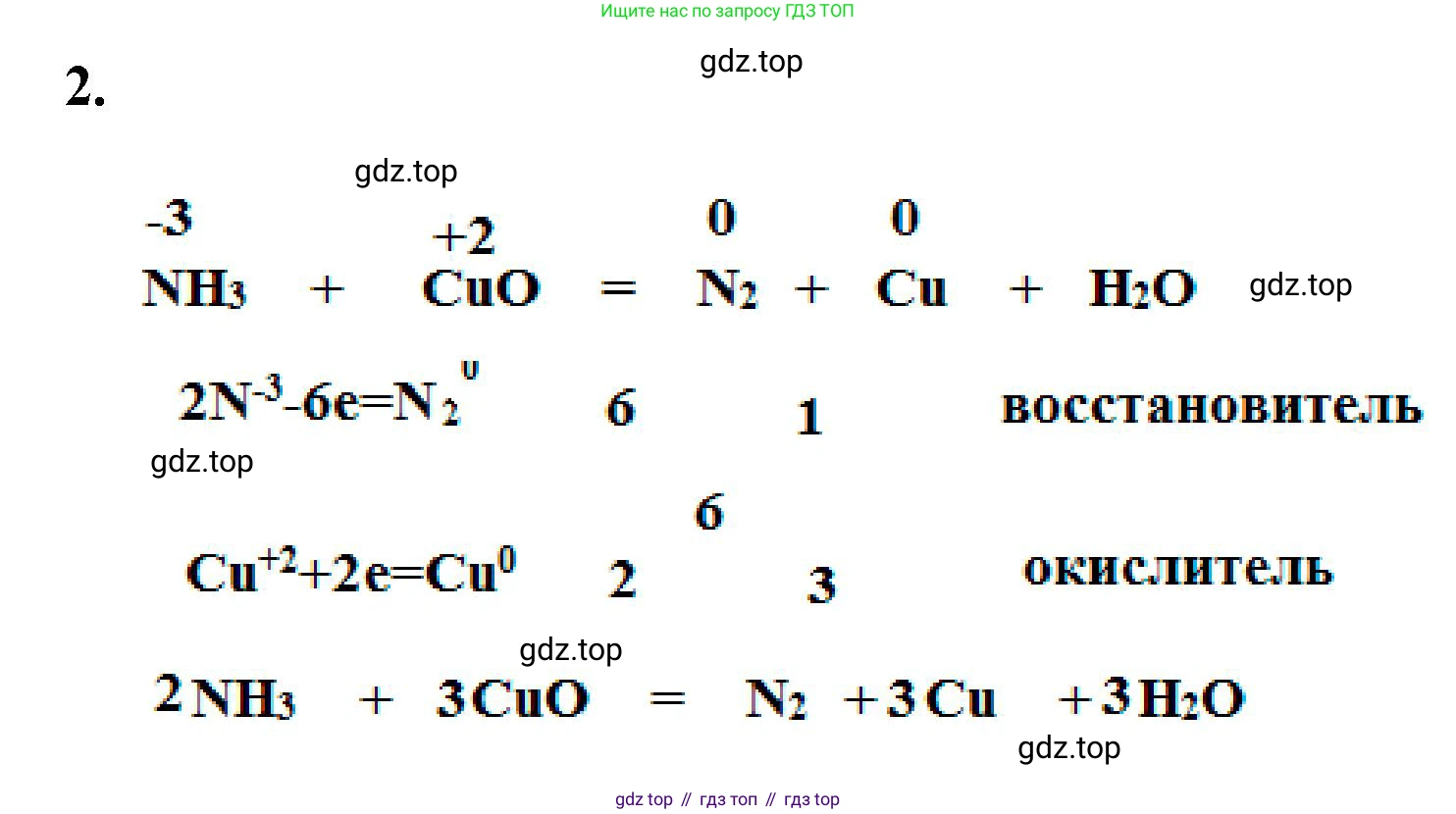
Решение 2. №2 (с. 70)
Решение
Данная реакция является окислительно-восстановительной. Аммиак ($NH_3$) является восстановителем, а оксид меди(II) ($CuO$) — окислителем. В ходе реакции азот, находящийся в степени окисления -3, окисляется до простого вещества — молекулярного азота ($N_2$) со степенью окисления 0. Медь, находящаяся в степени окисления +2, восстанавливается до металлической меди ($Cu$) со степенью окисления 0. Также в результате реакции образуется вода ($H_2O$).
Сначала запишем схему реакции с предполагаемыми продуктами:
$NH_3 + CuO \rightarrow N_2 + Cu + H_2O$
Для расстановки коэффициентов воспользуемся методом электронного баланса. Для этого определим степени окисления элементов, которые их изменяют в ходе реакции:
$N^{-3}H_3^{+1} + Cu^{+2}O^{-2} \rightarrow N_2^0 + Cu^0 + H_2^{+1}O^{-2}$
Элементы, изменившие свои степени окисления:
- Азот (N) с -3 до 0 (окисление).
- Медь (Cu) с +2 до 0 (восстановление).
Составим уравнения полуреакций окисления и восстановления:
$2N^{-3} - 6e^- \rightarrow N_2^0 \quad | \quad 1 \quad |$ процесс окисления (азот - восстановитель)
$Cu^{+2} + 2e^- \rightarrow Cu^0 \quad | \quad 3 \quad |$ процесс восстановления (медь - окислитель)
Число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем. Наименьшее общее кратное для чисел 6 и 2 равно 6. Поэтому коэффициенты для полуреакций равны 1 и 3 соответственно.
Переносим эти коэффициенты в уравнение реакции:
$2NH_3 + 3CuO \rightarrow N_2 + 3Cu + H_2O$
Последний шаг — уравниваем количество атомов водорода и кислорода. В левой части уравнения находится $2 \cdot 3 = 6$ атомов водорода. Чтобы уравнять их количество, ставим коэффициент 3 перед молекулой воды ($H_2O$) в правой части. Теперь проверим количество атомов кислорода: в левой части 3 атома (в $3CuO$), в правой части также 3 атома (в $3H_2O$). Уравнение сбалансировано.
Ответ: $2NH_3 + 3CuO = N_2 + 3Cu + 3H_2O$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 70 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 70), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















