Номер 4, страница 69 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §17. Аммиак. Часть 1 - номер 4, страница 69.
№4 (с. 69)
Условие. №4 (с. 69)
скриншот условия

4. Получение аммиака.
a) В лаборатории: _________
б) В промышленности: _________
Решение. №4 (с. 69)
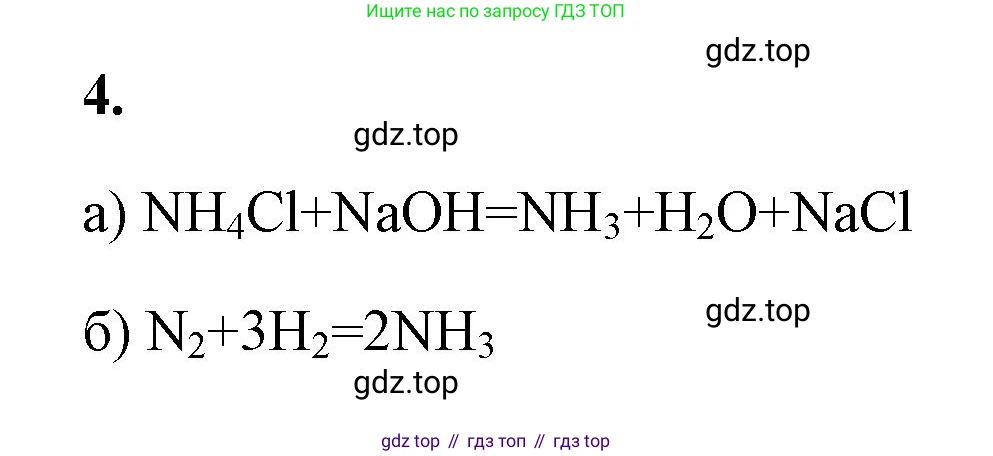
Решение 2. №4 (с. 69)
а) В лаборатории:
В лабораторных условиях аммиак ($NH_3$) получают путем взаимодействия солей аммония с сильными основаниями (щелочами) при нагревании. Чаще всего для этой цели используют смесь твердых хлорида аммония ($NH_4Cl$) и гидроксида кальция ($Ca(OH)_2$). При нагревании этой смеси происходит реакция обмена, в результате которой выделяется газообразный аммиак, который легко обнаружить по характерному резкому запаху или с помощью влажной индикаторной бумаги (фенолфталеиновой или лакмусовой), которая меняет свой цвет.
Уравнение химической реакции:
$2NH_4Cl(тв.) + Ca(OH)_2(тв.) \xrightarrow{t} CaCl_2(тв.) + 2NH_3(г) \uparrow + 2H_2O(ж)$
Ответ: В лаборатории аммиак получают нагреванием смеси соли аммония (например, хлорида аммония $NH_4Cl$) со щелочью (например, гидроксидом кальция $Ca(OH)_2$).
б) В промышленности:
Промышленный способ получения аммиака — это прямой синтез из азота ($N_2$) и водорода ($H_2$). Этот процесс называется процессом Габера-Боша. Азот для синтеза получают из сжиженного воздуха, а водород — конверсией метана (природного газа) или газификацией угля. Реакция синтеза аммиака является обратимой, экзотермической и протекает с уменьшением объёма газов.
Уравнение химической реакции:
$N_2(г) + 3H_2(г) \rightleftharpoons 2NH_3(г) + 92,4 \text{ кДж}$
Согласно принципу Ле Шателье, для смещения равновесия в сторону образования продукта (аммиака) необходимо создавать определенные условия:
- Высокое давление: процесс ведут при давлении 15–35 МПа (150–350 атмосфер), так как реакция идет с уменьшением числа молей газа (из 4 моль реагентов образуется 2 моль продукта).
- Повышенная температура: реакция экзотермическая, поэтому для смещения равновесия выгодна низкая температура. Однако при низкой температуре скорость реакции очень мала. Поэтому применяют компромиссную температуру 400–500 °C, которая обеспечивает приемлемую скорость реакции при достаточно высоком выходе аммиака.
- Использование катализатора: для увеличения скорости реакции используют катализатор — пористое железо с активаторами (промоторами), такими как оксиды алюминия ($Al_2O_3$), калия ($K_2O$) и кальция ($CaO$).
Ответ: В промышленности аммиак получают каталитическим синтезом из азота и водорода при высоком давлении (15-35 МПа) и температуре (400-500 °C) — процесс Габера-Боша.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 4 расположенного на странице 69 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 69), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















