Номер 4, страница 74 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §17. (продолжение). Соли аммония. Часть 2 - номер 4, страница 74.
№4 (с. 74)
Условие. №4 (с. 74)
скриншот условия

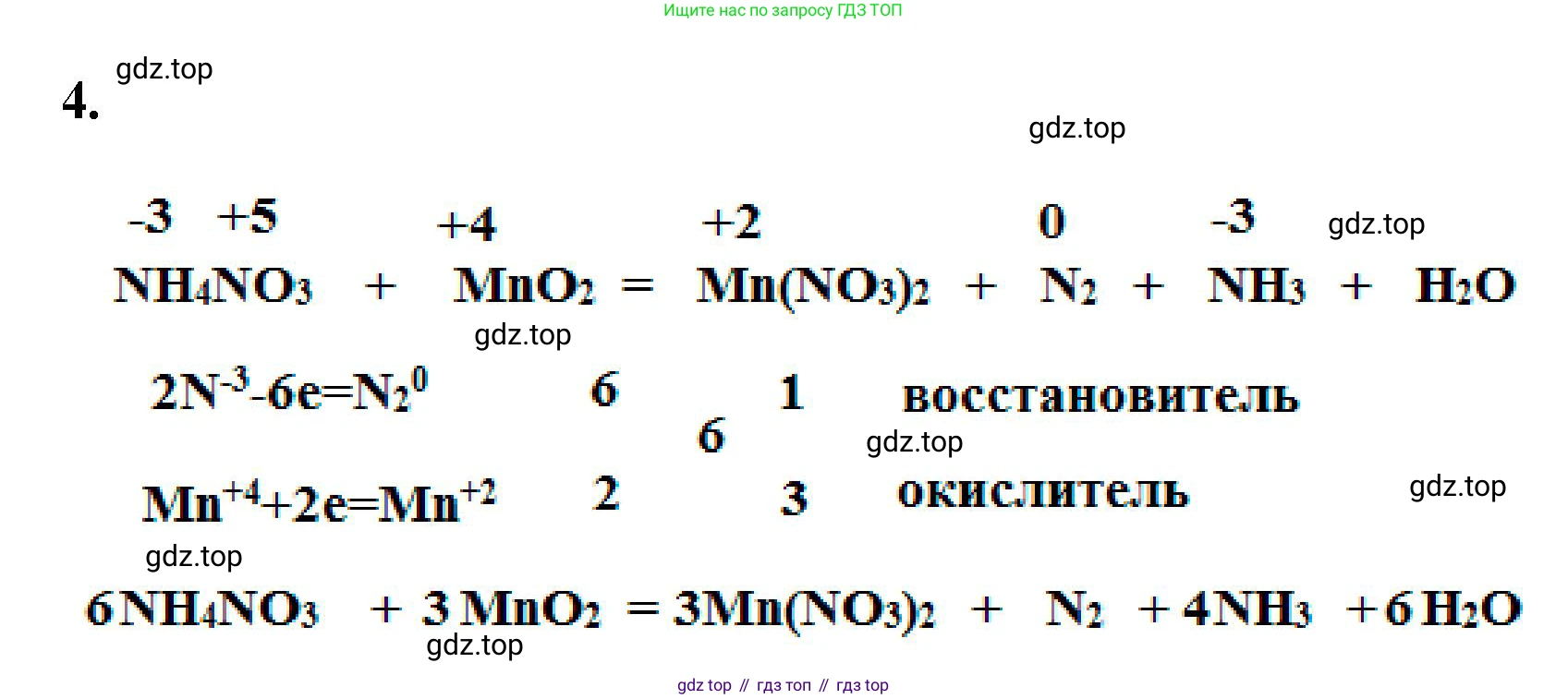
4. Дополните схему реакции. Расставьте коэффициенты с помощью метода электронного баланса.
$NH_4NO_3 + MnO_2 \to Mn(NO_3)_2 + N_2 + NH_3 + \underline{\hspace{2em}}$
Решение. №4 (с. 74)
Решение 2. №4 (с. 74)
Решение
Для решения задачи необходимо выполнить два шага: сначала дополнить схему реакции, определив недостающий продукт, а затем расставить коэффициенты, используя метод электронного баланса.
1. Дополнение схемы реакции.
В левой части уравнения даны реагенты: нитрат аммония ($NH_4NO_3$) и оксид марганца(IV) ($MnO_2$). В правой части указаны продукты: нитрат марганца(II) ($Mn(NO_3)_2$), азот ($N_2$) и аммиак ($NH_3$).
Проанализируем атомарный состав. В реагентах присутствуют атомы марганца ($Mn$), азота ($N$), водорода ($H$) и кислорода ($O$). В известных продуктах также присутствуют эти атомы. Чтобы уравнение было полным, необходимо учесть все атомы из реагентов. Водород из иона аммония ($NH_4^+$) и кислород из нитрат-иона ($NO_3^−$) и оксида марганца ($MnO_2$) должны образовать еще один продукт. Наиболее вероятным продуктом, состоящим из водорода и кислорода в таких реакциях, является вода ($H_2O$).
Таким образом, полная схема реакции выглядит следующим образом:
$NH_4NO_3 + MnO_2 \rightarrow Mn(NO_3)_2 + N_2 + NH_3 + H_2O$
2. Расстановка коэффициентов методом электронного баланса.
Определим степени окисления элементов, которые их изменяют:
$ \overset{-3}{N} \overset{+1}{H_4} \overset{+5}{N} \overset{-2}{O_3} + \overset{+4}{Mn} \overset{-2}{O_2} \rightarrow \overset{+2}{Mn} (\overset{+5}{N} \overset{-2}{O_3})_2 + \overset{0}{N_2} + \overset{-3}{N} \overset{+1}{H_3} + \overset{+1}{H_2} \overset{-2}{O} $
Степени окисления изменяют:
- Марганец, который восстанавливается с $Mn^{+4}$ до $Mn^{+2}$.
- Азот из иона аммония, который окисляется с $N^{-3}$ до $N_2^0$.
Составим полуреакции окисления и восстановления:
$Mn^{+4} + 2e^- \rightarrow Mn^{+2}$ | 3 | процесс восстановления, $MnO_2$ – окислитель
$2N^{-3} - 6e^- \rightarrow N_2^0$ | 1 | процесс окисления, $NH_4^+$ – восстановитель
Для баланса электронов умножим первую полуреакцию на 3, а вторую на 1. Это дает нам коэффициенты для веществ, содержащих эти элементы: перед $MnO_2$ и $Mn(NO_3)_2$ ставим коэффициент 3, а перед $N_2$ – коэффициент 1.
$...NH_4NO_3 + 3MnO_2 \rightarrow 3Mn(NO_3)_2 + 1N_2 + ...NH_3 + ...H_2O$
Теперь уравняем остальные элементы:
Азот (N): В правой части уравнения в $3Mn(NO_3)_2$ содержится $3 \cdot 2 = 6$ атомов азота в степени окисления +5. Эти атомы пришли из нитрат-ионов ($NO_3^−$). Значит, в реакцию должно было вступить как минимум 6 нитрат-ионов, а следовательно, 6 молекул $NH_4NO_3$.
Всего в 6 молекулах $NH_4NO_3$ содержится 6 ионов аммония ($NH_4^+$) с азотом в степени окисления -3. Согласно электронному балансу, 2 атома азота $N^{-3}$ окислились до $N_2$. Оставшиеся $6 - 2 = 4$ атома азота $N^{-3}$ должны перейти в аммиак. Следовательно, образуется 4 молекулы $NH_3$.
Подставим найденные коэффициенты:
$6NH_4NO_3 + 3MnO_2 \rightarrow 3Mn(NO_3)_2 + N_2 + 4NH_3 + ...H_2O$
Водород (H): В левой части в $6NH_4NO_3$ содержится $6 \cdot 4 = 24$ атома водорода. В правой части в $4NH_3$ содержится $4 \cdot 3 = 12$ атомов водорода. Оставшиеся $24 - 12 = 12$ атомов водорода входят в состав воды. Для этого требуется 6 молекул $H_2O$.
$6NH_4NO_3 + 3MnO_2 \rightarrow 3Mn(NO_3)_2 + N_2 + 4NH_3 + 6H_2O$
Кислород (O) (для проверки):
Слева: $6 \cdot 3 + 3 \cdot 2 = 18 + 6 = 24$ атома.
Справа: $3 \cdot (3 \cdot 2) + 6 \cdot 1 = 18 + 6 = 24$ атома.
Баланс атомов кислорода соблюдается, следовательно, коэффициенты расставлены верно.
Ответ:
$6NH_4NO_3 + 3MnO_2 \rightarrow 3Mn(NO_3)_2 + N_2 + 4NH_3 + 6H_2O$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 4 расположенного на странице 74 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 74), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















