Номер 6, страница 76 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §18. Оксиды азота. Азотная и азотистая кислоты. Часть 1 - номер 6, страница 76.
№6 (с. 76)
Условие. №6 (с. 76)
скриншот условия

Азотистую кислоту в свободном состоянии получить не удаётся, так как она обратимо диссоциирует:
Решение. №6 (с. 76)
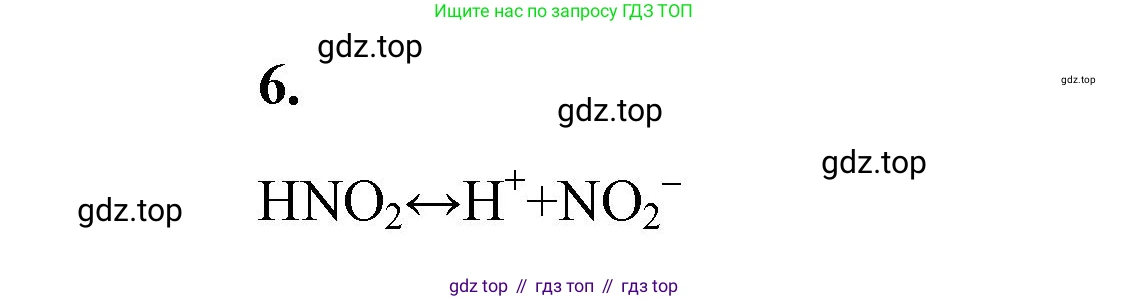
Решение 2. №6 (с. 76)
На изображении приведена предпосылка к задаче о химическом равновесии. Азотистая кислота ($HNO_2$), существующая только в разбавленных водных растворах, неустойчива и самопроизвольно диспропорционирует (обратимо диссоциирует) по следующему уравнению:
$3HNO_2 \rightleftharpoons HNO_3 + 2NO + H_2O$
Для решения полной задачи, которая обычно сопровождает это условие, необходимо рассчитать равновесные концентрации всех веществ. Предположим, что полная формулировка задачи следующая: "Вычислите равновесные концентрации всех веществ в растворе, полученном при растворении 4,7 г нитрита натрия в 100 мл 0,5 М раствора соляной кислоты. Константа равновесия реакции диспропорционирования равна 30. Объем раствора считать равным 100 мл."
Дано:$m(NaNO_2) = 4,7 \text{ г}$
$V(р-ра HCl) = 100 \text{ мл}$
$C_M(HCl) = 0,5 \text{ моль/л}$
$V_{общий} = 100 \text{ мл}$
$K_c = 30$
Перевод в СИ:
$V(р-ра HCl) = 100 \text{ мл} = 0,1 \text{ л}$
$V_{общий} = 100 \text{ мл} = 0,1 \text{ л}$
$[HNO_2]_{равн} - ?$
$[HNO_3]_{равн} - ?$
$[NO]_{равн} - ?$
1. При смешивании растворов нитрита натрия и соляной кислоты происходит реакция ионного обмена, в результате которой образуется азотистая кислота:
$NaNO_2 + HCl \rightarrow HNO_2 + NaCl$
2. Рассчитаем количество вещества (в молях) исходных реагентов.
Молярная масса нитрита натрия:
$M(NaNO_2) = 23 + 14 + 2 \cdot 16 = 69 \text{ г/моль}$
Количество вещества нитрита натрия:
$n(NaNO_2) = \frac{m(NaNO_2)}{M(NaNO_2)} = \frac{4,7 \text{ г}}{69 \text{ г/моль}} \approx 0,0681 \text{ моль}$
Количество вещества соляной кислоты:
$n(HCl) = C_M(HCl) \cdot V(р-ра HCl) = 0,5 \text{ моль/л} \cdot 0,1 \text{ л} = 0,05 \text{ моль}$
3. Определим лимитирующий реагент. Согласно уравнению реакции, реагенты взаимодействуют в стехиометрическом соотношении 1:1.
Поскольку $n(HCl) = 0,05 \text{ моль} < n(NaNO_2) = 0,0681 \text{ моль}$, соляная кислота находится в недостатке и прореагирует полностью. Расчеты будем вести по ней.
Количество образовавшейся азотистой кислоты равно количеству соляной кислоты:
$n(HNO_2)_{исх} = n(HCl) = 0,05 \text{ моль}$
4. Рассчитаем начальную концентрацию азотистой кислоты в общем объеме раствора 100 мл (0,1 л):
$C(HNO_2)_{исх} = \frac{n(HNO_2)_{исх}}{V_{общий}} = \frac{0,05 \text{ моль}}{0,1 \text{ л}} = 0,5 \text{ моль/л}$
5. Далее азотистая кислота диссоциирует (диспропорционирует) до установления равновесия:
$3HNO_2 \rightleftharpoons HNO_3 + 2NO + H_2O$
Для нахождения равновесных концентраций составим таблицу. Пусть $x$ моль/л – концентрация $HNO_3$, образовавшейся к моменту равновесия. Тогда, согласно стехиометрии, израсходуется $3x$ моль/л $HNO_2$ и образуется $2x$ моль/л $NO$.
Исходные концентрации:
$[HNO_2]_{исх} = 0,5 \text{ моль/л}$
$[HNO_3]_{исх} = 0 \text{ моль/л}$
$[NO]_{исх} = 0 \text{ моль/л}$
Равновесные концентрации:
$[HNO_2]_{равн} = 0,5 - 3x$
$[HNO_3]_{равн} = x$
$[NO]_{равн} = 2x$
6. Запишем выражение для константы равновесия $K_c$. Концентрация воды, как растворителя, является постоянной величиной и не включается в выражение.
$K_c = \frac{[HNO_3] \cdot [NO]^2}{[HNO_2]^3} = 30$
Подставим равновесные концентрации в выражение:
$30 = \frac{x \cdot (2x)^2}{(0,5 - 3x)^3} = \frac{4x^3}{(0,5 - 3x)^3}$
7. Решим полученное уравнение относительно $x$.
$\frac{30}{4} = \left(\frac{2x}{2(0,5 - 3x)}\right)^3 = \frac{4x^3}{(0,5-3x)^3} = 4 \left( \frac{x}{0,5 - 3x} \right)^3$
$\frac{30}{4} = 7,5 = \left(\frac{x}{0,5 - 3x}\right)^3$
Извлечем кубический корень из обеих частей уравнения:
$\sqrt[3]{7,5} = \frac{x}{0,5 - 3x}$
$1,9574 \approx \frac{x}{0,5 - 3x}$
$1,9574 \cdot (0,5 - 3x) = x$
$0,9787 - 5,8722x = x$
$0,9787 = x + 5,8722x$
$0,9787 = 6,8722x$
$x = \frac{0,9787}{6,8722} \approx 0,1424 \text{ моль/л}$
8. Теперь рассчитаем равновесные концентрации всех веществ.
$[HNO_3]_{равн} = x \approx 0,142 \text{ моль/л}$
$[NO]_{равн} = 2x = 2 \cdot 0,1424 \approx 0,285 \text{ моль/л}$
$[HNO_2]_{равн} = 0,5 - 3x = 0,5 - 3 \cdot 0,1424 = 0,5 - 0,4272 \approx 0,073 \text{ моль/л}$
Ответ: Равновесные концентрации веществ в растворе составляют: $[HNO_2] \approx 0,073 \text{ моль/л}$; $[HNO_3] \approx 0,142 \text{ моль/л}$; $[NO] \approx 0,285 \text{ моль/л}$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 6 расположенного на странице 76 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6 (с. 76), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















