Номер 3, страница 75 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §18. Оксиды азота. Азотная и азотистая кислоты. Часть 1 - номер 3, страница 75.
№3 (с. 75)
Условие. №3 (с. 75)
скриншот условия

3. Оксид азота(IV) $NO_2$ образует две кислоты:
$NO_2$ + $H_2O$ = _____ + _____,
и соответственно два ряда солей:
$NaOH$ + $NO_2$ = _____ + _____ + _____,
но в присутствии кислорода $NO_2$ + $H_2O$ + $O_2$ = _____
Для последней реакции составьте электронный баланс, укажите окислитель и восстановитель, процессы окисления и восстановления.
Решение. №3 (с. 75)
Решение 2. №3 (с. 75)
Оксид азота(IV) ($NO_2$) является оксидом с промежуточной степенью окисления азота (+4), поэтому при взаимодействии с водой он диспропорционирует, образуя одновременно две кислоты: азотную ($HNO_3$, степень окисления N = +5) и азотистую ($HNO_2$, степень окисления N = +3).
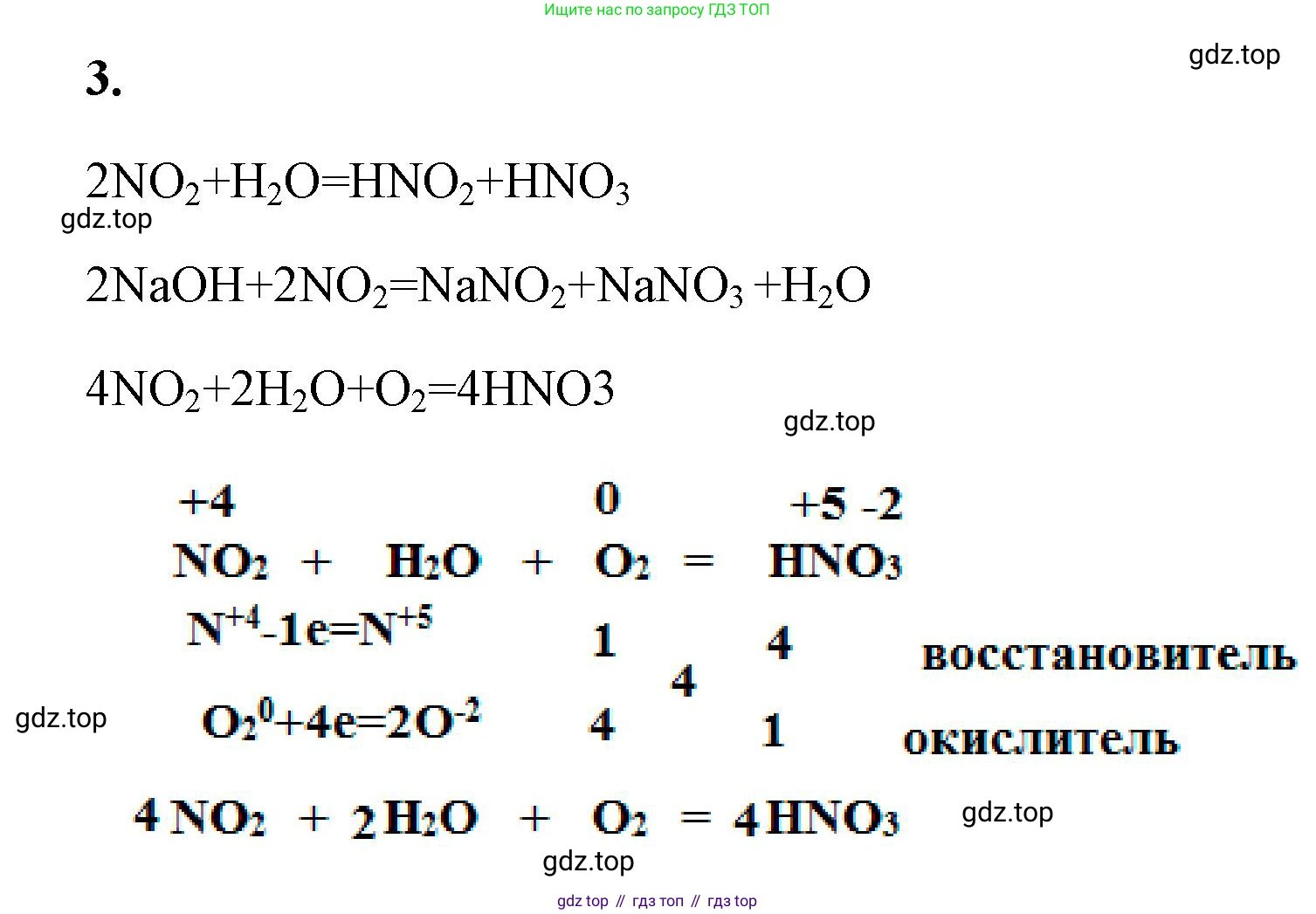
$2NO_2 + H_2O = HNO_3 + HNO_2$
Ответ: $HNO_3 + HNO_2$
При взаимодействии оксида азота(IV) со щелочью (например, $NaOH$) также происходит реакция диспропорционирования с образованием солей этих двух кислот — нитрата натрия ($NaNO_3$) и нитрита натрия ($NaNO_2$), а также воды.
$2NaOH + 2NO_2 = NaNO_3 + NaNO_2 + H_2O$
Ответ: $NaNO_3 + NaNO_2 + H_2O$
Однако в присутствии сильного окислителя, такого как кислород ($O_2$), оксид азота(IV) окисляется до высшей степени окисления +5, образуя только азотную кислоту ($HNO_3$).
$4NO_2 + 2H_2O + O_2 = 4HNO_3$
Ответ: $4HNO_3$
Для последней реакции ($4NO_2 + 2H_2O + O_2 = 4HNO_3$) составим электронный баланс, укажем окислитель и восстановитель, процессы окисления и восстановления.
Решение
Электронный баланс
Определим степени окисления элементов, которые их изменяют:
$N^{+4}$ в молекуле $NO_2$ повышает свою степень окисления до $N^{+5}$ в молекуле $HNO_3$.
$O^0$ в молекуле $O_2$ понижает свою степень окисления до $O^{-2}$ в молекуле $HNO_3$.
Составим уравнения полуреакций и найдем коэффициенты:
$N^{+4} - 1e^- \rightarrow N^{+5}$ | 4
$O_2^0 + 4e^- \rightarrow 2O^{-2}$ | 1
Окислитель и восстановитель
Восстановитель (отдает электроны): $NO_2$ (за счет атома азота $N^{+4}$).
Окислитель (принимает электроны): $O_2$ (за счет атомов кислорода $O^0$).
Процессы окисления и восстановления
Процесс окисления: $N^{+4} - 1e^- \rightarrow N^{+5}$
Процесс восстановления: $O_2^0 + 4e^- \rightarrow 2O^{-2}$
Ответ:
Электронный баланс:
$N^{+4} - 1e^- \rightarrow N^{+5}$ | 4
$O_2^0 + 4e^- \rightarrow 2O^{-2}$ | 1
Окислитель: $O_2$.
Восстановитель: $NO_2$.
Процесс окисления: $N^{+4} \rightarrow N^{+5}$.
Процесс восстановления: $O_2^0 \rightarrow 2O^{-2}$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 3 расположенного на странице 75 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 75), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















