Номер 2, страница 75 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава III. Неметаллы и их соединения. §18. Оксиды азота. Азотная и азотистая кислоты. Часть 1 - номер 2, страница 75.
№2 (с. 75)
Условие. №2 (с. 75)
скриншот условия

2. Получение оксидов азота(II) и азота(IV).
a) В промышленности в несколько стадий:
$N_2 \to NO \to NO_2$
$NH_3 \nearrow$
б) В лаборатории при реакции меди с азотной кислотой:
$Cu + HNO_3(\text{конц.}) = \underline{\hspace{2cm}} + \underline{\hspace{2cm}} + \underline{\hspace{2cm}}$
$Cu + HNO_3(\text{разб.}) = \underline{\hspace{2cm}} + \underline{\hspace{2cm}} + \underline{\hspace{2cm}}$
Решение. №2 (с. 75)
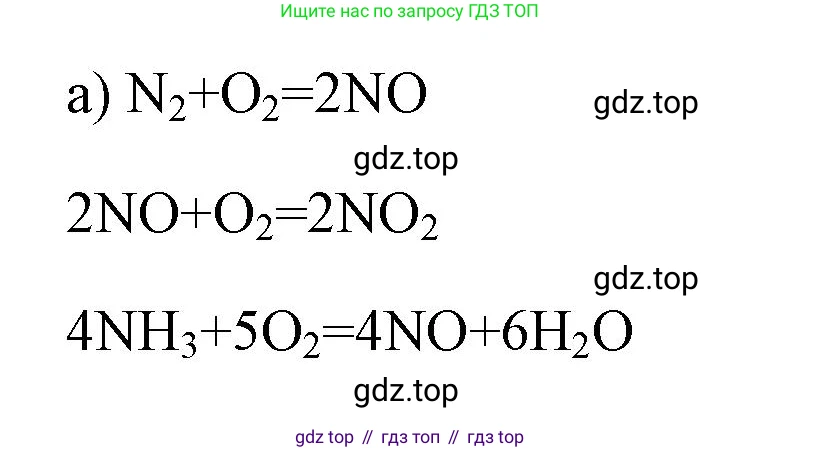

Решение 2. №2 (с. 75)
a) В промышленности в несколько стадий:
В промышленности оксид азота(II) ($NO$) и оксид азота(IV) ($NO_2$) получают в несколько этапов, что является частью процесса производства азотной кислоты.
1. Первая стадия — каталитическое окисление аммиака ($NH_3$) кислородом воздуха на платино-родиевом катализаторе при температуре около 800-950°C. В результате образуется оксид азота(II) ($NO$).
$4NH_3 + 5O_2 \xrightarrow{катализатор, t} 4NO + 6H_2O$
2. Вторая стадия — окисление полученного оксида азота(II) до оксида азота(IV) ($NO_2$). Эта реакция происходит самопроизвольно при охлаждении газовой смеси в присутствии кислорода.
$2NO + O_2 \rightarrow 2NO_2$
Ответ: Промышленный способ получения оксидов азота(II) и (IV) включает две стадии, описываемые уравнениями:
$4NH_3 + 5O_2 \rightarrow 4NO + 6H_2O$
$2NO + O_2 \rightarrow 2NO_2$
б) В лаборатории при реакции меди с азотной кислотой:
Азотная кислота является сильным окислителем, и продукты ее реакции с металлами, такими как медь, зависят от концентрации кислоты.
При реакции меди с концентрированной азотной кислотой ($HNO_3(\text{конц.})$) образуются нитрат меди(II) ($Cu(NO_3)_2$), оксид азота(IV) ($NO_2$) и вода ($H_2O$). Оксид азота(IV) — это газ бурого цвета.
$Cu + 4HNO_3(\text{конц.}) = Cu(NO_3)_2 + 2NO_2\uparrow + 2H_2O$
При реакции меди с разбавленной азотной кислотой ($HNO_3(\text{разб.})$) также образуются нитрат меди(II) и вода, но азотная кислота восстанавливается глубже — до оксида азота(II) ($NO$). Оксид азота(II) — бесцветный газ, который на воздухе окисляется до бурого $NO_2$.
$3Cu + 8HNO_3(\text{разб.}) = 3Cu(NO_3)_2 + 2NO\uparrow + 4H_2O$
Ответ:
$Cu + HNO_3(\text{конц.}) = Cu(NO_3)_2 + 2NO_2 + 2H_2O$
$Cu + HNO_3(\text{разб.}) = 3Cu(NO_3)_2 + 2NO + 4H_2O$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 75 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 75), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















