Номер 3, страница 118 - гдз по химии 9 класс рабочая тетрадь Габриелян, Сладков

Авторы: Габриелян О. С., Сладков С. А., Остроумов И. Г.
Тип: рабочая тетрадь
Издательство: Просвещение
Год издания: 2023 - 2026
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-100047-4
Популярные ГДЗ в 9 классе
Глава IV. Металлы и их соединения. §30. Общая характеристика элементов IА - группы. Часть 1 - номер 3, страница 118.
№3 (с. 118)
Условие. №3 (с. 118)
скриншот условия

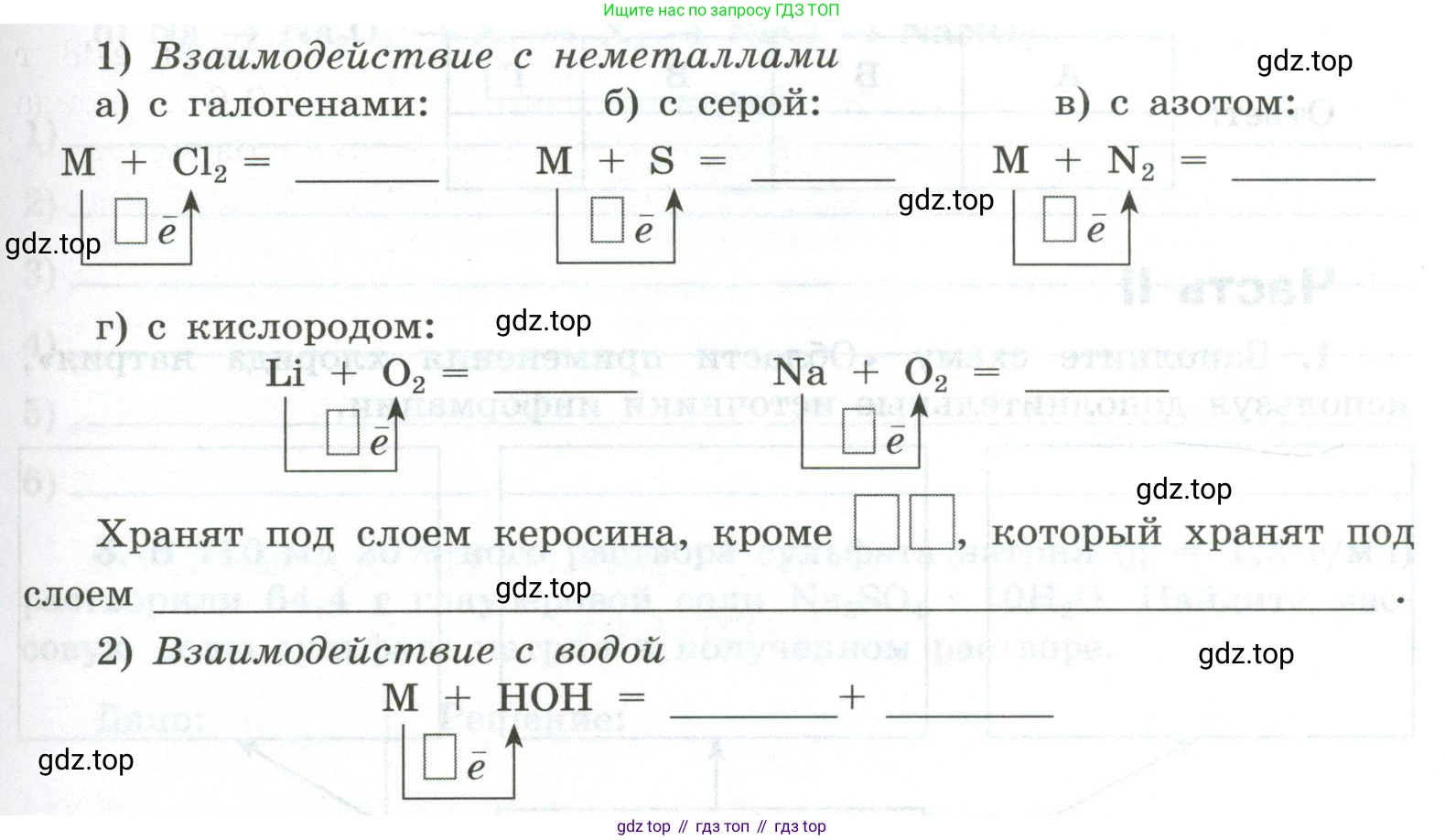
3. Химические свойства простых веществ описываются общим уравнением
$M^0 - \square \bar{e} \to M^{\square+}$, где M — металл
1) Взаимодействие с неметаллами
а) с галогенами:
$M + Cl_2 = \text{__________}$
$\begin{array}{c} \boxed{\quad} \\ \uparrow \\ \bar{e} \end{array}$
б) с серой:
$M + S = \text{__________}$
$\begin{array}{c} \boxed{\quad} \\ \uparrow \\ \bar{e} \end{array}$
в) с азотом:
$M + N_2 = \text{__________}$
$\begin{array}{c} \boxed{\quad} \\ \uparrow \\ \bar{e} \end{array}$
г) с кислородом:
$Li + O_2 = \text{__________}$
$\begin{array}{c} \boxed{\quad} \\ \uparrow \\ \bar{e} \end{array}$
$Na + O_2 = \text{__________}$
$\begin{array}{c} \boxed{\quad} \\ \uparrow \\ \bar{e} \end{array}$
Хранят под слоем керосина, кроме $\square\square$, который хранят под слоем $\text{__________}$.
2) Взаимодействие с водой
$M + HOH = \text{__________} + \text{__________}$
$\begin{array}{c} \boxed{\quad} \\ \uparrow \\ \bar{e} \end{array}$
Решение. №3 (с. 118)

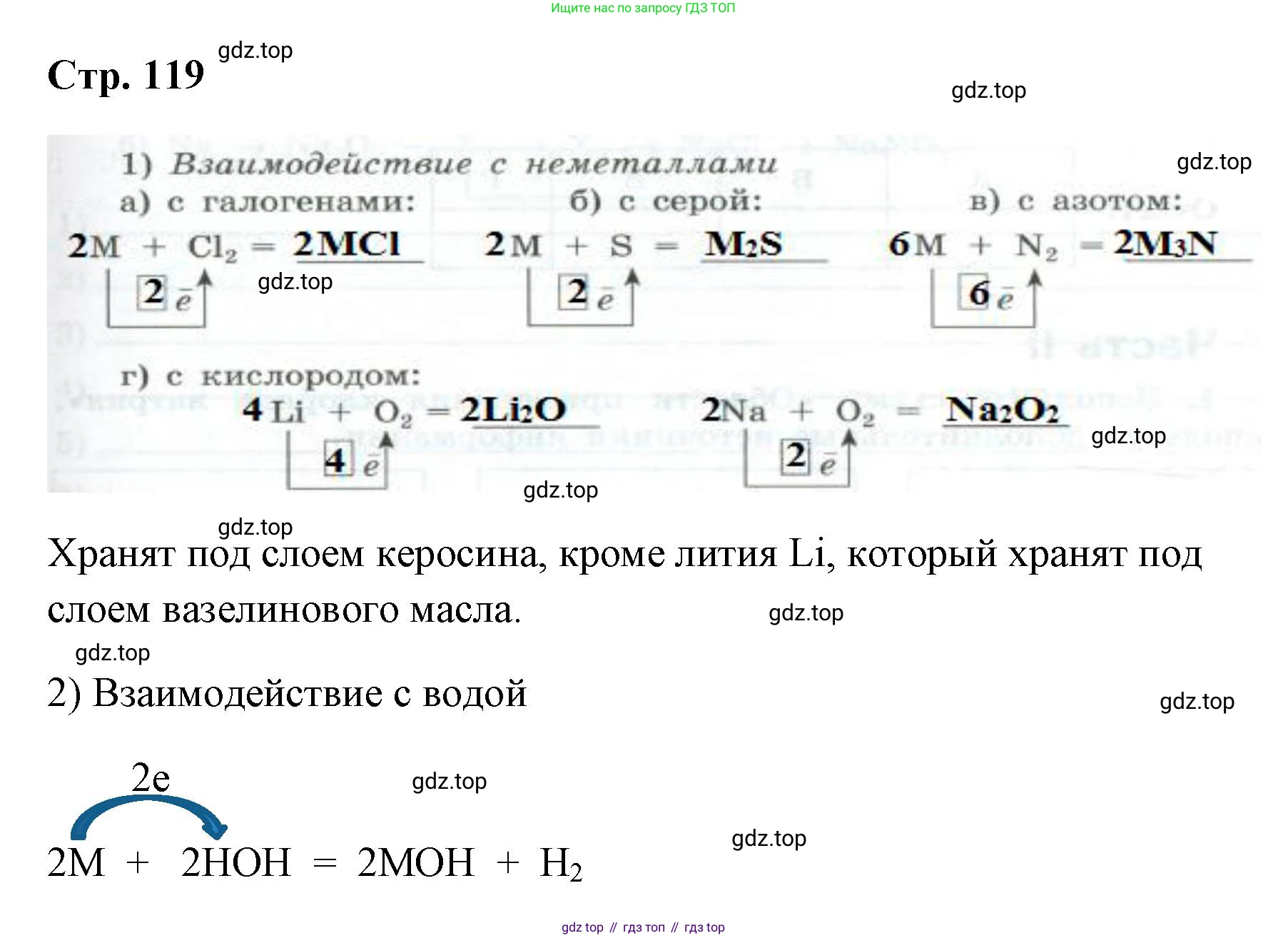
Решение 2. №3 (с. 118)
Общее уравнение, описывающее химические свойства щелочных металлов (M) как восстановителей, выглядит следующим образом:
$M^0 - 1\bar{e} \rightarrow M^{1+}$
Это означает, что атом металла (M), имеющий степень окисления 0, отдает один электрон ($\bar{e}$) и превращается в положительно заряженный ион (катион) с зарядом +1.
1) Взаимодействие с неметаллами
а) с галогенами:
Щелочные металлы (M) активно реагируют с галогенами, такими как хлор ($Cl_2$), образуя соли — галогениды (в данном случае хлориды). В этой реакции металл выступает в роли восстановителя, отдавая один электрон, а хлор — в роли окислителя, принимая электроны.
Уравнение реакции: $2M + Cl_2 = 2MCl$
Схема переноса электронов показывает, что каждый атом металла M отдает 1 электрон: $M^0 - 1\bar{e} \rightarrow M^{+1}$.
Ответ: В пропуск в уравнении реакции следует вписать $2MCl$. В рамку под уравнением, обозначающую число переданных электронов от одного атома металла, следует вписать 1.
б) с серой:
При нагревании щелочные металлы реагируют с серой (S), образуя сульфиды. Металл также является восстановителем, отдавая один электрон.
Уравнение реакции: $2M + S = M_2S$
Схема переноса электронов: $M^0 - 1\bar{e} \rightarrow M^{+1}$.
Ответ: В пропуск в уравнении реакции следует вписать $M_2S$. В рамку под уравнением следует вписать 1.
в) с азотом:
Из всех щелочных металлов только литий реагирует с азотом ($N_2$) при комнатной температуре. Остальные металлы этой группы реагируют с азотом при нагревании. В результате образуются нитриды.
Уравнение реакции: $6M + N_2 = 2M_3N$
Схема переноса электронов: $M^0 - 1\bar{e} \rightarrow M^{+1}$.
Ответ: В пропуск в уравнении реакции следует вписать $2M_3N$. В рамку под уравнением следует вписать 1.
г) с кислородом:
Продукты реакции щелочных металлов с кислородом ($O_2$) различаются. Литий образует оксид, натрий — пероксид, а калий, рубидий и цезий — надпероксиды (супероксиды).
Реакция лития с кислородом: $4Li + O_2 = 2Li_2O$ (оксид лития). В этой реакции каждый атом лития отдает один электрон: $Li^0 - 1\bar{e} \rightarrow Li^{+1}$.
Реакция натрия с кислородом: $2Na + O_2 = Na_2O_2$ (пероксид натрия). Каждый атом натрия также отдает один электрон: $Na^0 - 1\bar{e} \rightarrow Na^{+1}$.
Ответ: В пропуск в уравнении с литием следует вписать $2Li_2O$, а в рамку под ним — 1. В пропуск в уравнении с натрием следует вписать $Na_2O_2$, а в рамку под ним — 1.
Щелочные металлы очень активны, поэтому для предотвращения их реакции с компонентами воздуха (кислородом, парами воды, азотом) их хранят под слоем инертной жидкости. Обычно для этих целей используют керосин. Однако литий имеет очень низкую плотность (0,53 г/см³), которая меньше плотности керосина (около 0,8 г/см³), поэтому он будет плавать на его поверхности. В связи с этим литий хранят под слоем вазелинового или минерального масла, плотность которых ниже.
Ответ: Хранят под слоем керосина, кроме лития, который хранят под слоем вазелинового масла.
2) Взаимодействие с водой
Щелочные металлы бурно, часто со взрывом, реагируют с водой (HOH). В результате реакции образуется соответствующая щелочь (гидроксид металла) и выделяется газообразный водород ($H_2$).
Уравнение реакции: $2M + 2HOH = 2MOH + H_2\uparrow$
В этой окислительно-восстановительной реакции металл отдает один электрон ($M^0 - 1\bar{e} \rightarrow M^{+1}$), а водород в составе воды принимает электрон ($2H^{+1} + 2\bar{e} \rightarrow H_2^0$).
Ответ: В пропуски в уравнении реакции следует вписать $2MOH$ и $H_2$. В рамку под уравнением следует вписать 1.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 3 расположенного на странице 118 к рабочей тетради 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 118), авторов: Габриелян (Олег Саргисович), Сладков (Сергей Анатольевич), Остроумов (Игорь Геннадьевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















