Номер 22, страница 25 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2025
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
3. Повторение и обобщение материала, изученного в 8 классе. Упражнения и задачи для самостоятельного решения - номер 22, страница 25.
№22 (с. 25)
Условие. №22 (с. 25)
скриншот условия

22. Для реакции
$\text{K} + \text{HNO}_3 \rightarrow \text{KNO}_3 + \text{N}_2\text{O} + \text{H}_2\text{O}$
составьте электронный баланс, расставьте коэффициенты и укажите окислитель и восстановитель.
Решение. №22 (с. 25)
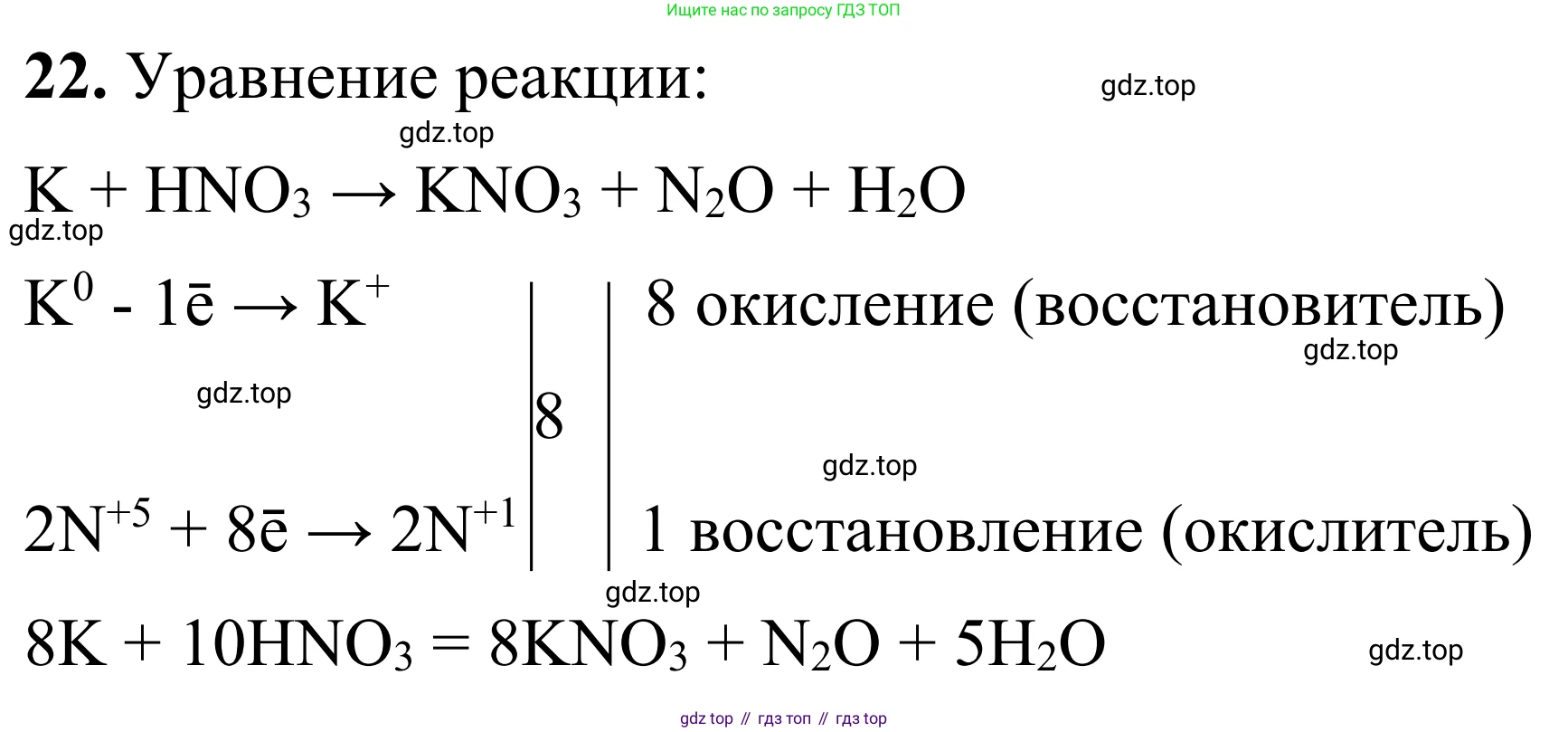
Решение 2. №22 (с. 25)
Решение
Для решения задачи воспользуемся методом электронного баланса. Сначала определим степени окисления элементов в каждом веществе до и после реакции, чтобы выявить, какие из них изменились.
Схема реакции с указанием степеней окисления:
$ \stackrel{0}{K} + H\stackrel{+1}{N}\stackrel{+5}{O_3}\stackrel{-2}{} \rightarrow \stackrel{+1}{K}\stackrel{+5}{N}\stackrel{-2}{O_3} + \stackrel{+1}{N_2}\stackrel{-2}{O} + \stackrel{+1}{H_2}\stackrel{-2}{O} $
Из схемы видно, что степени окисления изменили калий и азот:
- Калий ($K$) повышает степень окисления с $0$ до $+1$.
- Часть атомов азота ($N$) понижает степень окисления с $+5$ в азотной кислоте до $+1$ в оксиде азота(I).
Составим уравнения полуреакций окисления и восстановления (электронный баланс):
$ \stackrel{0}{K} - 1e^- \rightarrow \stackrel{+1}{K} $ 8| процесс окисления, $K$ — восстановитель
$ 2\stackrel{+5}{N} + 8e^- \rightarrow \stackrel{+1}{N}_2 $ 1| процесс восстановления, $N^{+5}$ (в $HNO_3$) — окислитель
Мы уравняли число отданных и принятых электронов, найдя наименьшее общее кратное (8). Полученные множители (8 и 1) являются коэффициентами в уравнении реакции для веществ, содержащих эти элементы.
Поставим коэффициент 8 перед калием ($K$) и нитратом калия ($KNO_3$), и коэффициент 1 перед оксидом азота(I) ($N_2O$):
$ 8K + HNO_3 \rightarrow 8KNO_3 + 1N_2O + H_2O $
Теперь уравняем количество атомов азота ($N$). В правой части уравнения $8$ атомов $N$ в $8KNO_3$ и $2$ атома $N$ в $N_2O$, всего $8 + 2 = 10$ атомов. Следовательно, в левой части перед $HNO_3$ необходимо поставить коэффициент 10.
$ 8K + 10HNO_3 \rightarrow 8KNO_3 + N_2O + H_2O $
Далее уравняем атомы водорода ($H$). В левой части в $10HNO_3$ содержится 10 атомов $H$. Чтобы в правой части также было 10 атомов $H$, ставим коэффициент 5 перед водой ($H_2O$).
$ 8K + 10HNO_3 \rightarrow 8KNO_3 + N_2O + 5H_2O $
В последнюю очередь выполним проверку по атомам кислорода ($O$):
- Слева: $10 \cdot 3 = 30$ атомов.
- Справа: $8 \cdot 3 + 1 + 5 \cdot 1 = 24 + 1 + 5 = 30$ атомов.
Баланс атомов соблюден, коэффициенты расставлены верно.
Ответ: Итоговое уравнение реакции с расставленными коэффициентами: $8K + 10HNO_3 \rightarrow 8KNO_3 + N_2O + 5H_2O$.
Электронный баланс:
$K^0 - 1e^- \rightarrow K^{+1}$ (окисление)
$2N^{+5} + 8e^- \rightarrow N_2^{+1}$ (восстановление)
Окислителем является азотная кислота $HNO_3$ (за счет $N^{+5}$), восстановителем — калий $K$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 22 расположенного на странице 25 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №22 (с. 25), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















