Номер 18, страница 64 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
7. Кислород, сера и их соединения. Упражнения и задачи для самостоятельного решения - номер 18, страница 64.
№18 (с. 64)
Условие. №18 (с. 64)
скриншот условия


18. Подберите коэффициенты в схемах окислительно-восстановительных реакций с помощью метода электронного баланса, укажите окислитель и восстановитель.
а) $NO_2 + O_2 + H_2O \to HNO_3$
б) $NH_3 + O_2 \to N_2 + H_2O$
в) $Fe(OH)_2 + O_2 + H_2O \to Fe(OH)_3$
г) $ZnS + O_2 \to ZnO + SO_2$
Решение. №18 (с. 64)
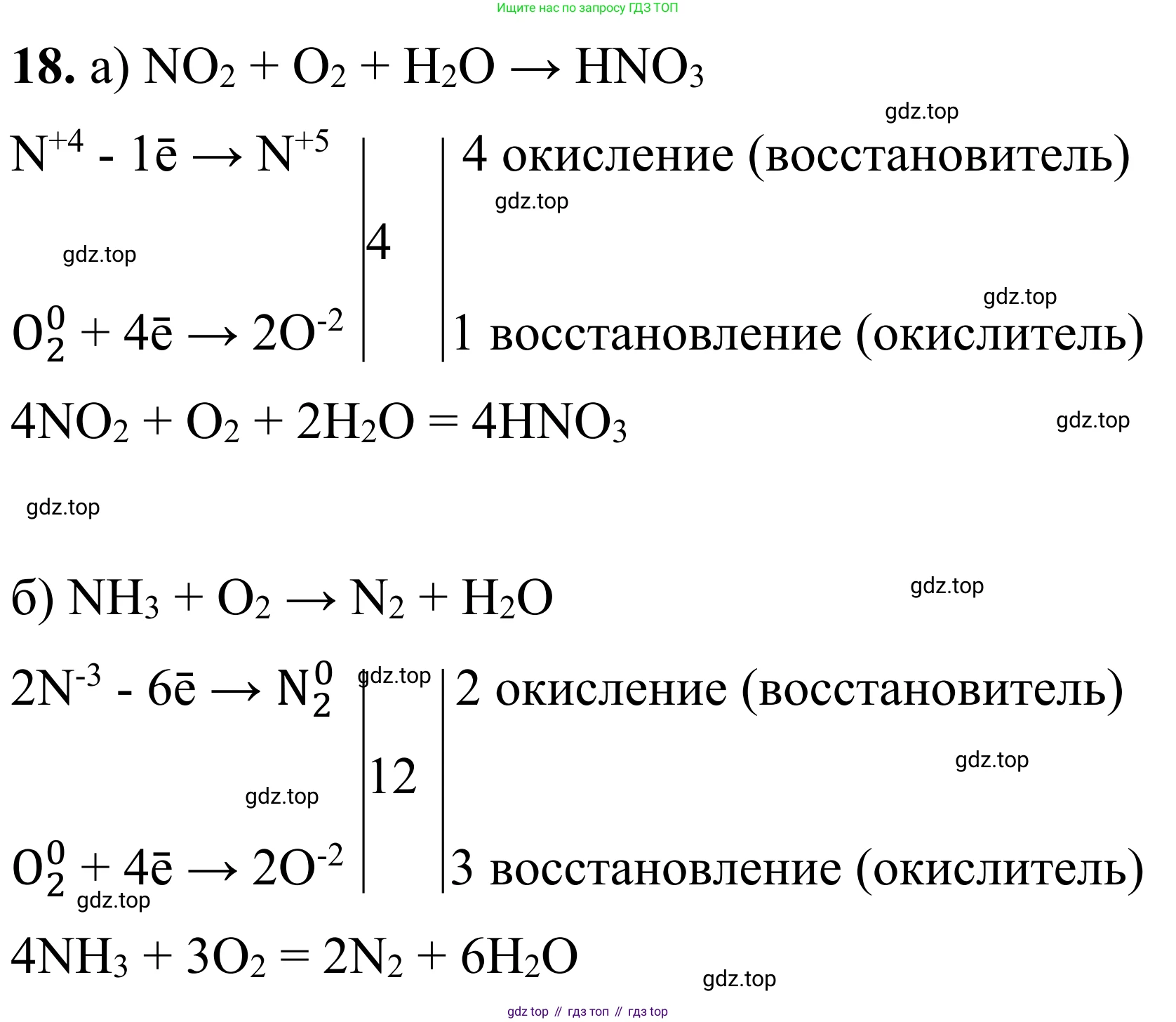

Решение 2. №18 (с. 64)
а) Решение
Рассмотрим схему реакции: $NO_2 + O_2 + H_2O \rightarrow HNO_3$.
Определим степени окисления элементов, которые их изменяют:
$N^{+4}O_2 + O_2^0 + H_2O \rightarrow HN^{+5}O_3$
Азот в $NO_2$ имеет степень окисления +4 и повышает ее до +5 в $HNO_3$. Кислород в $O_2$ имеет степень окисления 0 и понижает ее до -2 в $HNO_3$.
Составим электронный баланс:
$N^{+4} - 1e^- \rightarrow N^{+5}$ | $\times$ 4 (восстановитель, процесс окисления)
$O_2^0 + 4e^- \rightarrow 2O^{-2}$ | $\times$ 1 (окислитель, процесс восстановления)
Из баланса следует, что коэффициент перед $NO_2$ и $HNO_3$ равен 4, а перед $O_2$ - 1.
$4NO_2 + O_2 + H_2O \rightarrow 4HNO_3$
Теперь уравняем количество атомов водорода и кислорода. Справа 4 атома водорода, значит слева перед $H_2O$ ставим коэффициент 2.
$4NO_2 + O_2 + 2H_2O \rightarrow 4HNO_3$
Проверим количество атомов кислорода: слева $4 \cdot 2 + 2 + 2 \cdot 1 = 12$, справа $4 \cdot 3 = 12$. Уравнение сбалансировано.
Ответ: $4NO_2 + O_2 + 2H_2O = 4HNO_3$; $NO_2$ (за счет $N^{+4}$) — восстановитель, $O_2$ (за счет $O^0$) — окислитель.
б) Решение
Рассмотрим схему реакции: $NH_3 + O_2 \rightarrow N_2 + H_2O$.
Определим степени окисления элементов, которые их изменяют:
$N^{-3}H_3 + O_2^0 \rightarrow N_2^0 + H_2O^{-2}$
Азот в $NH_3$ имеет степень окисления -3 и повышает ее до 0 в $N_2$. Кислород в $O_2$ имеет степень окисления 0 и понижает ее до -2 в $H_2O$.
Составим электронный баланс, учитывая, что молекула азота двухатомна:
$2N^{-3} - 6e^- \rightarrow N_2^0$ | $\times$ 2 (восстановитель, процесс окисления)
$O_2^0 + 4e^- \rightarrow 2O^{-2}$ | $\times$ 3 (окислитель, процесс восстановления)
Наименьшее общее кратное для 6 и 4 равно 12. Расставляем коэффициенты: $2 \times 2 = 4$ для $NH_3$; $3$ для $O_2$.
$4NH_3 + 3O_2 \rightarrow N_2 + H_2O$
Уравняем остальные атомы. Слева 4 атома азота, значит перед $N_2$ ставим 2. Слева $4 \cdot 3 = 12$ атомов водорода, значит перед $H_2O$ ставим 6.
$4NH_3 + 3O_2 \rightarrow 2N_2 + 6H_2O$
Проверим количество атомов кислорода: слева $3 \cdot 2 = 6$, справа $6 \cdot 1 = 6$. Уравнение сбалансировано.
Ответ: $4NH_3 + 3O_2 = 2N_2 + 6H_2O$; $NH_3$ (за счет $N^{-3}$) — восстановитель, $O_2$ (за счет $O^0$) — окислитель.
в) Решение
Рассмотрим схему реакции: $Fe(OH)_2 + O_2 + H_2O \rightarrow Fe(OH)_3$.
Определим степени окисления элементов, которые их изменяют:
$Fe^{+2}(OH)_2 + O_2^0 + H_2O \rightarrow Fe^{+3}(OH)_3$
Железо в $Fe(OH)_2$ имеет степень окисления +2 и повышает ее до +3 в $Fe(OH)_3$. Кислород в $O_2$ имеет степень окисления 0 и понижает ее до -2 (входит в состав гидроксид-ионов).
Составим электронный баланс:
$Fe^{+2} - 1e^- \rightarrow Fe^{+3}$ | $\times$ 4 (восстановитель, процесс окисления)
$O_2^0 + 4e^- \rightarrow 2O^{-2}$ | $\times$ 1 (окислитель, процесс восстановления)
Из баланса следует, что коэффициент перед $Fe(OH)_2$ и $Fe(OH)_3$ равен 4, а перед $O_2$ - 1.
$4Fe(OH)_2 + O_2 + H_2O \rightarrow 4Fe(OH)_3$
Теперь уравняем количество атомов водорода и кислорода. Справа $4 \cdot 3 = 12$ атомов водорода, слева в $4Fe(OH)_2$ их $4 \cdot 2 = 8$. Недостающие 4 атома водорода берем из воды, ставя коэффициент 2 перед $H_2O$.
$4Fe(OH)_2 + O_2 + 2H_2O \rightarrow 4Fe(OH)_3$
Проверим количество атомов кислорода: слева $4 \cdot 2 + 2 + 2 \cdot 1 = 12$, справа $4 \cdot 3 = 12$. Уравнение сбалансировано.
Ответ: $4Fe(OH)_2 + O_2 + 2H_2O = 4Fe(OH)_3$; $Fe(OH)_2$ (за счет $Fe^{+2}$) — восстановитель, $O_2$ (за счет $O^0$) — окислитель.
г) Решение
Рассмотрим схему реакции: $ZnS + O_2 \rightarrow ZnO + SO_2$.
Определим степени окисления элементов, которые их изменяют:
$Zn^{+2}S^{-2} + O_2^0 \rightarrow Zn^{+2}O^{-2} + S^{+4}O_2^{-2}$
Сера в $ZnS$ имеет степень окисления -2 и повышает ее до +4 в $SO_2$. Кислород в $O_2$ имеет степень окисления 0 и понижает ее до -2 в $ZnO$ и $SO_2$. Цинк степень окисления не меняет.
Составим электронный баланс:
$S^{-2} - 6e^- \rightarrow S^{+4}$ | $\times$ 2 (восстановитель, процесс окисления)
$O_2^0 + 4e^- \rightarrow 2O^{-2}$ | $\times$ 3 (окислитель, процесс восстановления)
Наименьшее общее кратное для 6 и 4 равно 12. Коэффициент перед $ZnS$ (и $S^{-2}$) будет 2, а перед $O_2$ - 3.
$2ZnS + 3O_2 \rightarrow ZnO + SO_2$
Уравняем остальные атомы. Слева 2 атома цинка и 2 атома серы, значит справа ставим коэффициент 2 перед $ZnO$ и 2 перед $SO_2$.
$2ZnS + 3O_2 \rightarrow 2ZnO + 2SO_2$
Проверим количество атомов кислорода: слева $3 \cdot 2 = 6$, справа $2 \cdot 1 + 2 \cdot 2 = 2 + 4 = 6$. Уравнение сбалансировано.
Ответ: $2ZnS + 3O_2 = 2ZnO + 2SO_2$; $ZnS$ (за счет $S^{-2}$) — восстановитель, $O_2$ (за счет $O^0$) — окислитель.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 18 расположенного на странице 64 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №18 (с. 64), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















