Номер 14, страница 88 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
9. Углерод, кремний и их соединения. Упражнения и задачи для самостоятельного решения - номер 14, страница 88.
№14 (с. 88)
Условие. №14 (с. 88)
скриншот условия

14. Составьте уравнения всех возможных реакций между растворами следующих веществ: гидрокарбоната натрия ($NaHCO_3$), гидроксида кальция ($Ca(OH)_2$), сернистой кислоты ($H_2SO_3$), углекислого газа ($CO_2$).
Решение. №14 (с. 88)
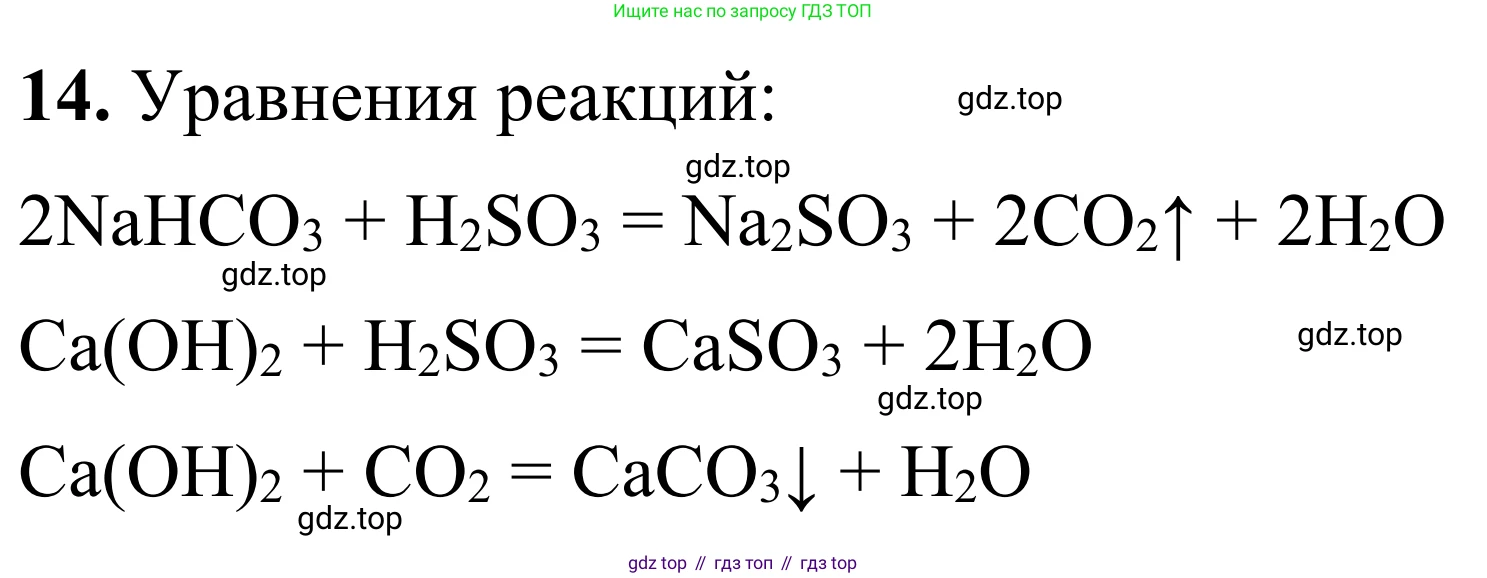
Решение 2. №14 (с. 88)
Решение
Рассмотрим все возможные химические реакции между водными растворами следующих веществ: гидрокарбоната натрия ($NaHCO_3$), гидроксида кальция ($Ca(OH)_2$), сернистой кислоты ($H_2SO_3$) и углекислого газа ($CO_2$, который в воде образует угольную кислоту $H_2CO_3$).
1. Гидрокарбонат натрия и гидроксид кальция
Гидрокарбонат натрия ($NaHCO_3$) является кислой солью и реагирует со щелочью $Ca(OH)_2$. В зависимости от соотношения реагентов, возможны два варианта реакции, в обоих случаях образуется нерастворимый карбонат кальция $CaCO_3$.
а) При мольном соотношении $NaHCO_3 : Ca(OH)_2 = 2:1$ (или в избытке гидрокарбоната) образуются две средние соли и вода:
$2NaHCO_3 + Ca(OH)_2 \rightarrow CaCO_3\downarrow + Na_2CO_3 + 2H_2O$
б) При мольном соотношении $NaHCO_3 : Ca(OH)_2 = 1:1$ (или в избытке щелочи) образуется средняя соль, щелочь и вода:
$NaHCO_3 + Ca(OH)_2 \rightarrow CaCO_3\downarrow + NaOH + H_2O$
Ответ: $2NaHCO_3 + Ca(OH)_2 \rightarrow CaCO_3\downarrow + Na_2CO_3 + 2H_2O$; $NaHCO_3 + Ca(OH)_2 \rightarrow CaCO_3\downarrow + NaOH + H_2O$.
2. Гидрокарбонат натрия и сернистая кислота
Сернистая кислота ($H_2SO_3$) является более сильной кислотой, чем угольная ($H_2CO_3$), поэтому она вытесняет угольную кислоту из ее соли. Неустойчивая угольная кислота разлагается на воду и углекислый газ.
а) При избытке сернистой кислоты (или соотношении 1:1) образуется кислая соль гидросульфит натрия:
$H_2SO_3 + NaHCO_3 \rightarrow NaHSO_3 + H_2O + CO_2\uparrow$
б) При избытке гидрокарбоната натрия (соотношение 1:2) образуется средняя соль сульфит натрия:
$H_2SO_3 + 2NaHCO_3 \rightarrow Na_2SO_3 + 2H_2O + 2CO_2\uparrow$
Ответ: $H_2SO_3 + NaHCO_3 \rightarrow NaHSO_3 + H_2O + CO_2\uparrow$; $H_2SO_3 + 2NaHCO_3 \rightarrow Na_2SO_3 + 2H_2O + 2CO_2\uparrow$.
3. Гидроксид кальция и сернистая кислота
Это реакция нейтрализации между основанием и двухосновной кислотой. Продукты зависят от соотношения реагентов.
а) При избытке основания (или соотношении 1:1) образуется нерастворимая средняя соль сульфит кальция:
$Ca(OH)_2 + H_2SO_3 \rightarrow CaSO_3\downarrow + 2H_2O$
б) При избытке кислоты (соотношение 1:2) образуется растворимая кислая соль гидросульфит кальция:
$Ca(OH)_2 + 2H_2SO_3 \rightarrow Ca(HSO_3)_2 + 2H_2O$
Ответ: $Ca(OH)_2 + H_2SO_3 \rightarrow CaSO_3\downarrow + 2H_2O$; $Ca(OH)_2 + 2H_2SO_3 \rightarrow Ca(HSO_3)_2 + 2H_2O$.
4. Гидроксид кальция и углекислый газ
Кислотный оксид $CO_2$ реагирует с раствором щелочи $Ca(OH)_2$.
а) При недостатке или эквимолярном количестве $CO_2$ образуется белый осадок карбоната кальция:
$Ca(OH)_2 + CO_2 \rightarrow CaCO_3\downarrow + H_2O$
б) При избытке $CO_2$ осадок растворяется, образуя растворимую кислую соль гидрокарбонат кальция. Суммарное уравнение:
$Ca(OH)_2 + 2CO_2 \rightarrow Ca(HCO_3)_2$
Ответ: $Ca(OH)_2 + CO_2 \rightarrow CaCO_3\downarrow + H_2O$; $Ca(OH)_2 + 2CO_2 \rightarrow Ca(HCO_3)_2$.
Остальные пары веществ не вступают в реакцию в данных условиях:
- Гидрокарбонат натрия и углекислый газ: в водном растворе $CO_2$ образует угольную кислоту $H_2CO_3$. Раствор гидрокарбоната натрия уже содержит ионы $HCO_3^-$, являющиеся продуктом диссоциации угольной кислоты. Новых веществ не образуется.
- Сернистая кислота и углекислый газ: обе являются кислотами (в водном растворе) и друг с другом не реагируют.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 14 расположенного на странице 88 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №14 (с. 88), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















