Номер 42, страница 91 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
9. Углерод, кремний и их соединения. Упражнения и задачи для самостоятельного решения - номер 42, страница 91.
№42 (с. 91)
Условие. №42 (с. 91)
скриншот условия

42. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) $силицид\ магния \rightarrow силан \rightarrow диоксид\ кремния \rightarrow силикат\ кальция \rightarrow сульфат\ кальция \rightarrow гидросульфат\ кальция \rightarrow сульфат\ кальция$
б) $кремнезём \rightarrow кремний \rightarrow силикат\ калия \rightarrow кремниевая\ кислота \rightarrow диоксид\ кремния$
в) $кремний \rightarrow силицид\ кальция \rightarrow силан \rightarrow диоксид\ кремния \rightarrow силикат\ натрия \rightarrow силикат\ кальция \rightarrow диоксид\ кремния$
Решение. №42 (с. 91)

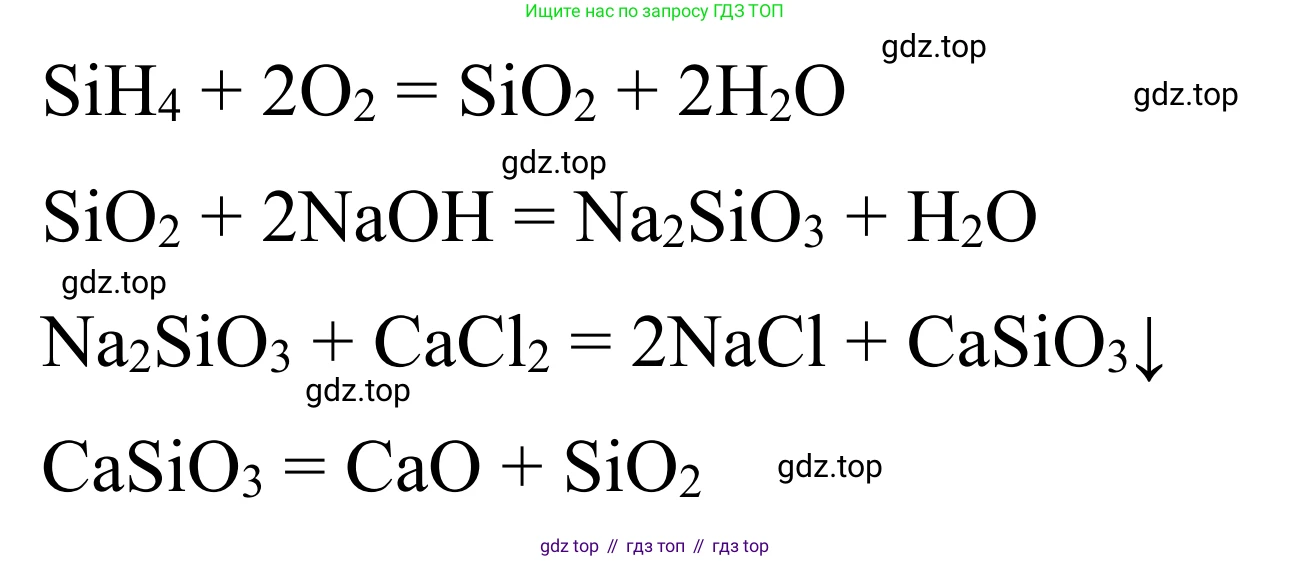
Решение 2. №42 (с. 91)
а) 1. Получение силана ($SiH_4$) из силицида магния ($Mg_2Si$) взаимодействием с соляной кислотой. Силициды активных металлов гидролизуются кислотами с выделением силана.
$Mg_2Si + 4HCl \rightarrow 2MgCl_2 + SiH_4 \uparrow$
2. Получение диоксида кремния ($SiO_2$) путем сжигания силана в кислороде. Силан самовоспламеняется на воздухе.
$SiH_4 + 2O_2 \xrightarrow{t} SiO_2 + 2H_2O$
3. Получение силиката кальция ($CaSiO_3$) сплавлением кислотного оксида кремния ($SiO_2$) с солью более слабой и летучей угольной кислоты (карбонатом кальция).
$SiO_2 + CaCO_3 \xrightarrow{t} CaSiO_3 + CO_2 \uparrow$
4. Получение сульфата кальция ($CaSO_4$) из силиката кальция. Сильная серная кислота вытесняет слабую кремниевую кислоту из ее соли. Оба продукта выпадают в осадок.
$CaSiO_3 + H_2SO_4 \rightarrow CaSO_4 \downarrow + H_2SiO_3 \downarrow$
5. Превращение сульфата кальция в гидросульфат кальция ($Ca(HSO_4)_2$) происходит при действии избытка концентрированной серной кислоты.
$CaSO_4 + H_2SO_4(\text{конц.}) \rightarrow Ca(HSO_4)_2$
6. Превращение кислой соли (гидросульфата) в среднюю соль (сульфат) путем нейтрализации основанием.
$Ca(HSO_4)_2 + Ca(OH)_2 \rightarrow 2CaSO_4 \downarrow + 2H_2O$
Ответ:
$Mg_2Si + 4HCl \rightarrow 2MgCl_2 + SiH_4 \uparrow$
$SiH_4 + 2O_2 \xrightarrow{t} SiO_2 + 2H_2O$
$SiO_2 + CaCO_3 \xrightarrow{t} CaSiO_3 + CO_2 \uparrow$
$CaSiO_3 + H_2SO_4 \rightarrow CaSO_4 \downarrow + H_2SiO_3 \downarrow$
$CaSO_4 + H_2SO_4(\text{конц.}) \rightarrow Ca(HSO_4)_2$
$Ca(HSO_4)_2 + Ca(OH)_2 \rightarrow 2CaSO_4 \downarrow + 2H_2O$
б) 1. Получение кремния ($Si$) из кремнезёма ($SiO_2$) путем восстановления активным металлом, например, магнием (магнийтермия), при высокой температуре.
$SiO_2 + 2Mg \xrightarrow{t} Si + 2MgO$
2. Получение силиката калия ($K_2SiO_3$) при реакции кремния с водным раствором щёлочи при нагревании. Кремний проявляет кислотные свойства.
$Si + 2KOH + H_2O \xrightarrow{t} K_2SiO_3 + 2H_2 \uparrow$
3. Получение кремниевой кислоты ($H_2SiO_3$) из раствора ее соли (силиката калия) действием более сильной кислоты, которая вытесняет кремниевую кислоту в виде осадка.
$K_2SiO_3 + 2HCl \rightarrow 2KCl + H_2SiO_3 \downarrow$
4. Получение диоксида кремния ($SiO_2$) термическим разложением (прокаливанием) неустойчивой кремниевой кислоты.
$H_2SiO_3 \xrightarrow{t} SiO_2 + H_2O$
Ответ:
$SiO_2 + 2Mg \xrightarrow{t} Si + 2MgO$
$Si + 2KOH + H_2O \xrightarrow{t} K_2SiO_3 + 2H_2 \uparrow$
$K_2SiO_3 + 2HCl \rightarrow 2KCl + H_2SiO_3 \downarrow$
$H_2SiO_3 \xrightarrow{t} SiO_2 + H_2O$
в) 1. Получение силицида кальция ($Ca_2Si$) прямым взаимодействием кремния с кальцием при нагревании.
$Si + 2Ca \xrightarrow{t} Ca_2Si$
2. Получение силана ($SiH_4$) из силицида кальция при реакции с кислотой (аналогично п. а).
$Ca_2Si + 4HCl \rightarrow 2CaCl_2 + SiH_4 \uparrow$
3. Получение диоксида кремния ($SiO_2$) сжиганием силана (аналогично п. а).
$SiH_4 + 2O_2 \xrightarrow{t} SiO_2 + 2H_2O$
4. Получение силиката натрия ($Na_2SiO_3$) при реакции диоксида кремния с раствором гидроксида натрия.
$SiO_2 + 2NaOH \rightarrow Na_2SiO_3 + H_2O$
5. Получение нерастворимого силиката кальция ($CaSiO_3$) из растворимого силиката натрия путем реакции ионного обмена с растворимой солью кальция (например, хлоридом кальция).
$Na_2SiO_3 + CaCl_2 \rightarrow CaSiO_3 \downarrow + 2NaCl$
6. Превращение силиката кальция в диоксид кремния. Этот переход осуществляется в две стадии: сначала действием сильной кислоты получают нерастворимую кремниевую кислоту, а затем её прокаливают до оксида.
$CaSiO_3 + 2HCl \rightarrow CaCl_2 + H_2SiO_3 \downarrow$
$H_2SiO_3 \xrightarrow{t} SiO_2 + H_2O$
Ответ:
$Si + 2Ca \xrightarrow{t} Ca_2Si$
$Ca_2Si + 4HCl \rightarrow 2CaCl_2 + SiH_4 \uparrow$
$SiH_4 + 2O_2 \xrightarrow{t} SiO_2 + 2H_2O$
$SiO_2 + 2NaOH \rightarrow Na_2SiO_3 + H_2O$
$Na_2SiO_3 + CaCl_2 \rightarrow CaSiO_3 \downarrow + 2NaCl$
$CaSiO_3 + 2HCl \rightarrow CaCl_2 + H_2SiO_3 \downarrow$; затем $H_2SiO_3 \xrightarrow{t} SiO_2 + H_2O$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 42 расположенного на странице 91 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №42 (с. 91), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















