Номер 2, страница 94 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
9. Углерод, кремний и их соединения. Домашний эксперимент - номер 2, страница 94.
№2 (с. 94)
Условие. №2 (с. 94)
скриншот условия

2. Взаимодействие пищевой соды с кислотами
Очень часто в кулинарии для приготовления теста используют пищевую соду в сочетании с уксусом. В рецептах обычно рекомендуют «добавить $\frac{1}{3}$ чайной ложки соды, погашенной уксусом». Конечно, мы с вами уже понимаем, что дело не во вкусовых качествах соды и уксуса, а в реакции между ними. Образующийся углекислый газ насыщает тесто, делая его более лёгким и пышным. Сейчас в продаже есть готовые смеси-разрыхлители, содержащие соду и кристаллики лимонной кислоты. Проведите эксперимент, сравните результаты и сделайте вывод, имеет ли смысл тратить деньги на такие смеси или лучше обойтись традиционным средством.
В три ёмкости (это могут быть маленькие баночки или даже пластмассовые крышки) насыпьте одинаковые количества пищевой соды, а в четвёртую — такое же количество готового разрыхлителя из магазина. В первые три ёмкости добавьте одинаковые объёмы кислот, которые можно использовать для кулинарии, — раствор столового уксуса, сок лимона, сок винограда (можно использовать соки других фруктов, которые есть дома). В ёмкость с разрыхлителем для инициирования реакции необходимо добавить несколько капель воды. Наблюдайте за ходом эксперимента, постарайтесь примерно оценить количество выделяющегося газа. Заполните таблицу и составьте уравнение реакции между пищевой содой и уксусной кислотой в молекулярной, полной и сокращённой ионной форме. Сокращённое ионное уравнение (т. е. суть реакции) будет одинаково для всех кислот, которые вы использовали.
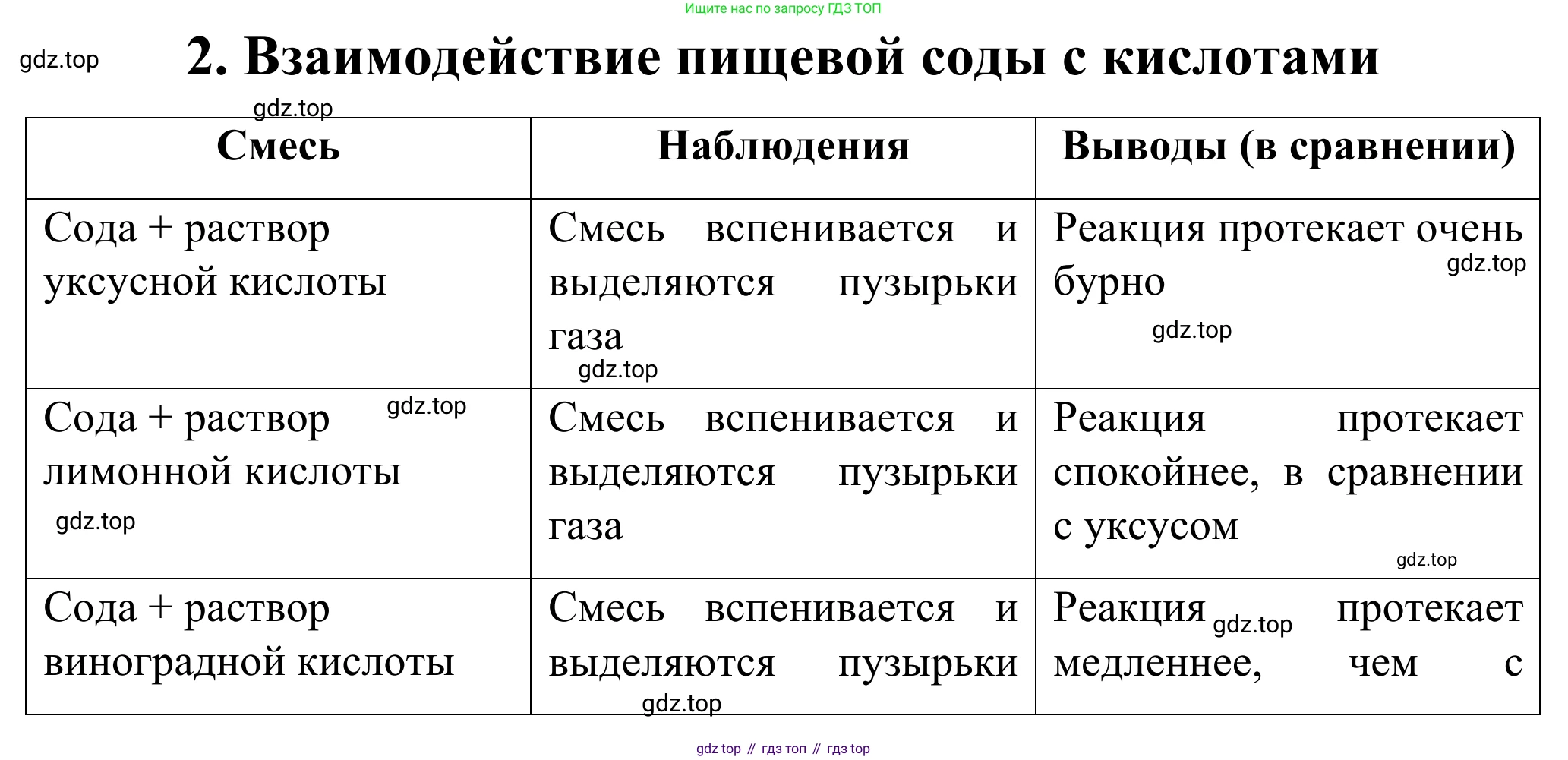
Смесь
Наблюдения
Выводы (в сравнении)
Сода + раствор уксусной кислоты
Сода + раствор лимонной кислоты
Сода + раствор виноградной кислоты
Смесь-разрыхлитель
Уравнение реакции:
Решение. №2 (с. 94)

Решение 2. №2 (с. 94)
Решение
Для ответа на поставленный вопрос необходимо проанализировать результаты описанного эксперимента, заполнив предоставленную таблицу, составить уравнения реакции и сделать итоговый вывод.
| Смесь | Наблюдения | Выводы (в сравнении) |
| Сода + раствор уксусной кислоты | Бурная, быстрая реакция с обильным выделением газа (шипение, образование пены). | Очень эффективный способ разрыхления. Реакция начинается мгновенно, что требует немедленной выпечки. Необходимо точно соблюдать пропорции, чтобы избежать привкуса соды или уксуса. |
| Сода + раствор лимонной кислоты | Очень активная, бурная реакция, сравнимая или даже более интенсивная, чем с уксусом. | Лимонная кислота (или сок) — отличная альтернатива уксусу. Реакция очень эффективна. Натуральный сок может придать выпечке легкий цитрусовый аромат. |
| Сода + раствор виноградной кислоты | Заметное выделение газа, но реакция может быть менее интенсивной по сравнению с чистыми кислотами. | Фруктовые соки можно использовать, но результат менее предсказуем из-за разной и зачастую невысокой концентрации кислоты в них. |
| Смесь-разрыхлитель | При добавлении воды начинается равномерное, контролируемое выделение газа, без "взрывного" эффекта. | Очень удобен в применении. Сбалансированный состав обеспечивает предсказуемый результат и нейтральный вкус. Часто имеет "двойное действие" (вторая стадия разрыхления при нагреве), что делает выпечку пышнее. |
Уравнение реакции:
Реакция между пищевой содой (гидрокарбонатом натрия, $NaHCO_3$) и уксусной кислотой ($CH_3COOH$) описывается следующими уравнениями:
Молекулярное уравнение:
$NaHCO_3 + CH_3COOH \rightarrow CH_3COONa + H_2O + CO_2 \uparrow$
Полное ионное уравнение (уксусная кислота является слабой и в растворе в основном находится в молекулярной форме):
$Na^+(aq) + HCO_3^-(aq) + CH_3COOH(aq) \rightarrow Na^+(aq) + CH_3COO^-(aq) + H_2O(l) + CO_2(g) \uparrow$
Сокращённое ионное уравнение (после сокращения ионов-наблюдателей $Na^+$):
$HCO_3^-(aq) + CH_3COOH(aq) \rightarrow CH_3COO^-(aq) + H_2O(l) + CO_2(g) \uparrow$
Суть реакции (общее сокращённое ионное уравнение) для всех использованных кислот заключается во взаимодействии гидрокарбонат-иона с протоном ($H^+$), который предоставляет кислота. В результате образуется нестойкая угольная кислота ($H_2CO_3$), которая распадается на воду и углекислый газ:
$HCO_3^-(aq) + H^+(aq) \rightarrow H_2O(l) + CO_2(g) \uparrow$
Ответ: Выбор между готовым разрыхлителем и традиционным методом «сода + кислота» зависит от приоритетов.
Готовый разрыхлитель целесообразно использовать, если в приоритете удобство, скорость и предсказуемость результата. Он идеален для начинающих кулинаров и для рецептов, требующих стабильного и равномерного подъема теста, так как исключает ошибки в пропорциях и часто обладает двойным действием.
Традиционный способ (гашение соды уксусом, лимонным соком и т.д.) является более экономичным решением, так как его компоненты широко доступны и дешевы. Этот метод подходит опытным кулинарам, которые могут точно отмерить ингредиенты и знают, что тесто нужно выпекать немедленно после введения гашеной соды.
Таким образом, тратить деньги на готовые смеси имеет смысл ради удобства и гарантии качества, в то время как традиционный метод остается полностью эффективным и бюджетным вариантом.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 94 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 94), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















