Номер 5, страница 28 - гдз по химии 9 класс тетрадь для лабораторных опытов и практических работ Габриелян, Аксенова

Авторы: Габриелян О. С., Аксенова И. В., Остроумов И. Г.
Тип: Тетрадь для лабораторных опытов и практических работ
Издательство: Просвещение
Год издания: 2020 - 2025
Цвет обложки: белый, синий
ISBN: 978-5-09-072533-0
Популярные ГДЗ в 9 классе
Зависимость скорости реакции от концентраций реагирующих веществ. Лабораторный опыт 10 - номер 5, страница 28.
№5 (с. 28)
Условие. №5 (с. 28)
скриншот условия
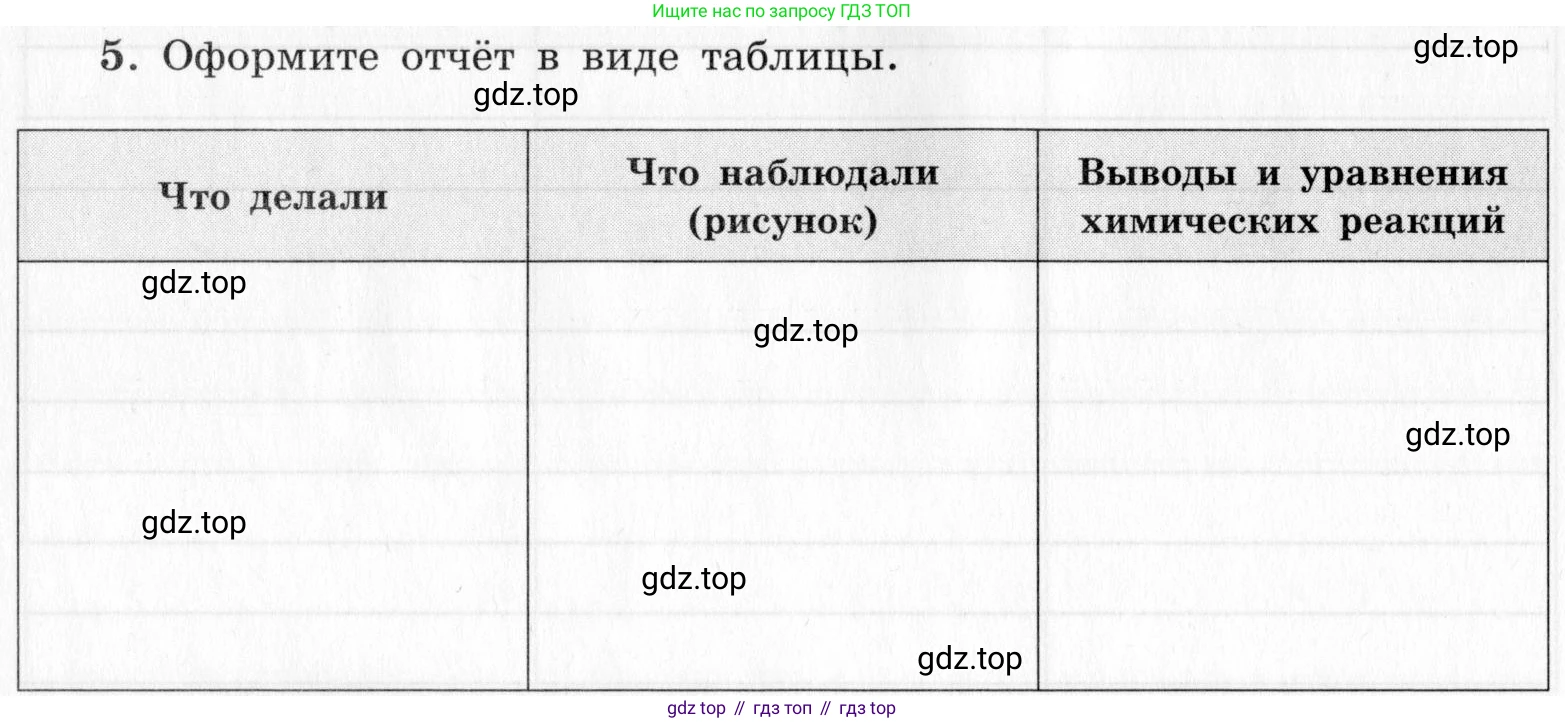
5. Оформите отчёт в виде таблицы.
| Что делали | Что наблюдали (рисунок) | Выводы и уравнения химических реакций |
|---|---|---|
Решение. №5 (с. 28)

Решение 2. №5 (с. 28)
| Что делали | Что наблюдали (рисунок) | Выводы и уравнения химических реакций |
|---|---|---|
| Добавление раствора гидроксида натрия к раствору соляной кислоты с индикатором фенолфталеином. | Исходный раствор с фенолфталеином малиновый, при добавлении щелочи становится бесцветным. (Рисунок: колба с малиновым раствором и капельница с прозрачной жидкостью; после добавления жидкости раствор становится бесцветным) | Вывод: Произошла реакция нейтрализации между кислотой и основанием. Уравнение: $ \text{NaOH} + \text{HCl} \to \text{NaCl} + \text{H}_2\text{O} $ Ионное уравнение: $ \text{Na}^+ + \text{OH}^- + \text{H}^+ + \text{Cl}^- \to \text{Na}^+ + \text{Cl}^- + \text{H}_2\text{O} $ Сокращенное ионное уравнение: $ \text{H}^+ + \text{OH}^- \to \text{H}_2\text{O} $ |
| Помещение гранулы цинка в пробирку с раствором серной кислоты. | На поверхности гранулы цинка наблюдается интенсивное выделение пузырьков газа. Гранула цинка постепенно уменьшается в размерах. (Рисунок: пробирка с жидкостью и погруженной гранулой, от которой отходят пузырьки газа) | Вывод: Цинк, как активный металл, вытесняет водород из кислоты. Уравнение: $ \text{Zn} + \text{H}_2\text{SO}_4 \to \text{ZnSO}_4 + \text{H}_2 \uparrow $ Ионное уравнение: $ \text{Zn} + 2\text{H}^+ + \text{SO}_4^{2-} \to \text{Zn}^{2+} + \text{SO}_4^{2-} + \text{H}_2 \uparrow $ Сокращенное ионное уравнение: $ \text{Zn} + 2\text{H}^+ \to \text{Zn}^{2+} + \text{H}_2 \uparrow $ |
| Нагревание гидроксида меди(II) в пробирке. | Синий осадок гидроксида меди(II) превращается в черный порошок оксида меди(II). На стенках пробирки появляются капли бесцветной жидкости (воды). (Рисунок: пробирка с синим осадком, нагреваемая пламенем; изменение цвета осадка на черный, конденсат на стенках) | Вывод: При нагревании гидроксид меди(II) разлагается на оксид меди(II) и воду. Уравнение: $ \text{Cu(OH)}_2 \xrightarrow{t^\circ} \text{CuO} + \text{H}_2\text{O} $ |
| Погружение железного гвоздя в раствор сульфата меди(II). | Поверхность железного гвоздя покрывается красноватым налетом (медью). Голубая окраска раствора сульфата меди(II) постепенно бледнеет. (Рисунок: стакан с голубым раствором, погруженный гвоздь; на гвозде образуется красный налет, раствор становится светлее) | Вывод: Железо, как более активный металл, вытесняет медь из раствора ее соли. Уравнение: $ \text{Fe} + \text{CuSO}_4 \to \text{FeSO}_4 + \text{Cu} \downarrow $ Ионное уравнение: $ \text{Fe} + \text{Cu}^{2+} + \text{SO}_4^{2-} \to \text{Fe}^{2+} + \text{SO}_4^{2-} + \text{Cu} \downarrow $ Сокращенное ионное уравнение: $ \text{Fe} + \text{Cu}^{2+} \to \text{Fe}^{2+} + \text{Cu} \downarrow $ |
Ответ: Отчет оформлен в виде таблицы с указанием проведенных действий, наблюдаемых явлений (с описанием гипотетического рисунка) и выводов с уравнениями химических реакций.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 5 расположенного на странице 28 к Тетрадь для лабораторных опытов и практических работ 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 28), авторов: Габриелян (Олег Саргисович), Аксенова (Инна Васильевна), Остроумов (Игорь Геннадьевич), ФГОС (старый) учебного пособия издательства Просвещение.















