Вариант 1, страница 100 - гдз по химии 9 класс тетрадь для лабораторных опытов и практических работ Габриелян, Аксенова

Авторы: Габриелян О. С., Аксенова И. В., Остроумов И. Г.
Тип: Тетрадь для лабораторных опытов и практических работ
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, синий
ISBN: 978-5-09-072533-0
Популярные ГДЗ в 9 классе
Решение экспериментальных задач по теме «Теория электролитической диссоциации». Практическая работа 1 - страница 100.
Вариант 1 (с. 100)
Условие. Вариант 1 (с. 100)
скриншот условия

Вариант 1
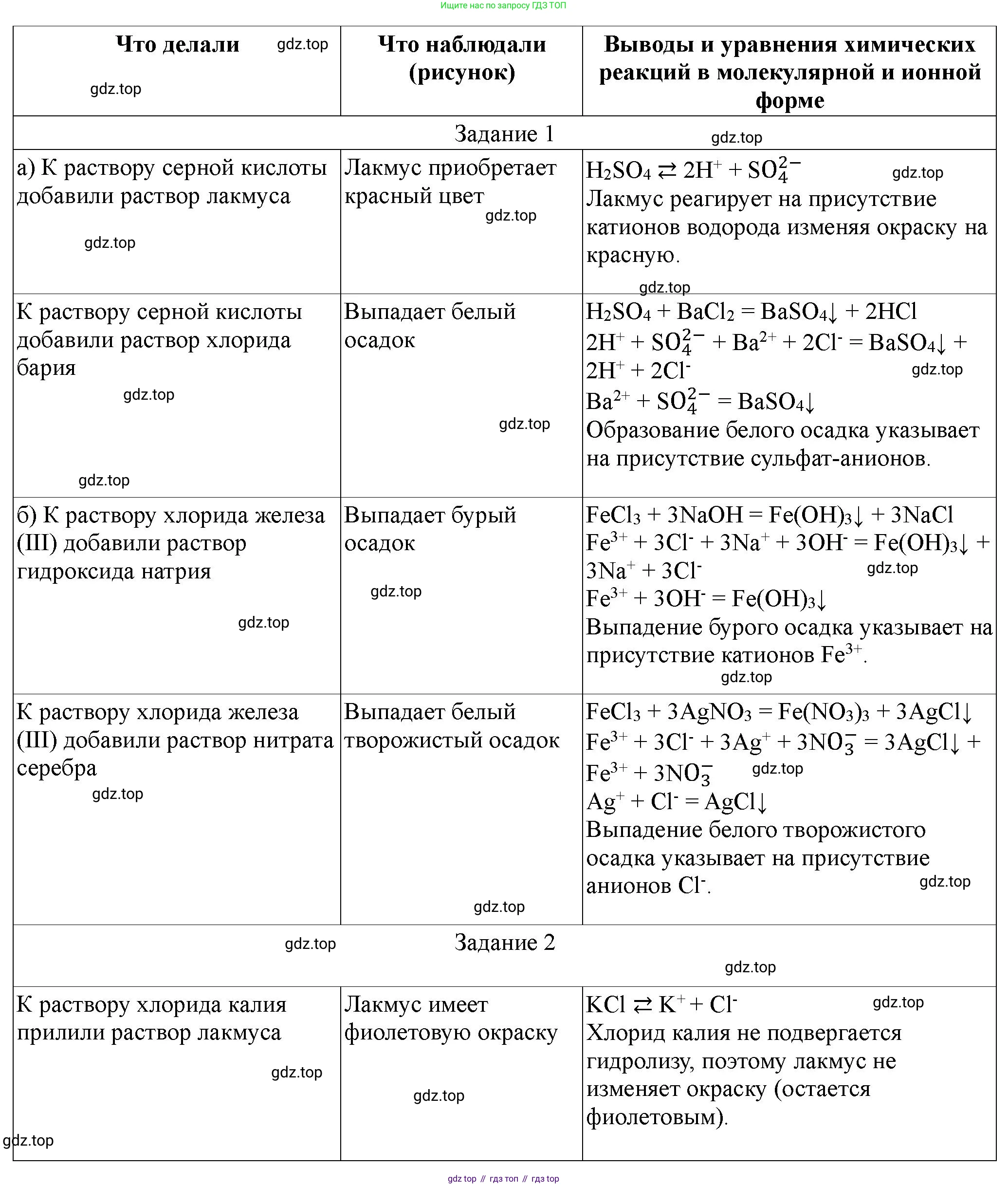
1. Идентификация веществ. Докажите опытным путём состав:
а) серной кислоты;
б) хлорида железа(III).
2. Гидролиз солей. Испытайте растворы хлорида калия, карбоната калия и хлорида цинка раствором индикатора или индикаторной бумагой и объясните результаты испытаний. Запишите молекулярные и ионные уравнения реакций гидролиза.
3. Последовательные превращения химических веществ. Осуществите на практике следующие превращения:
$\text{CuSO}_4 \to \text{Cu(OH)}_2 \to \text{CuO} \to \text{CuCl}_2 \to \text{Cu}$
Решение. Вариант 1 (с. 100)
Решение 2. Вариант 1 (с. 100)
1. Идентификация веществ. Докажите опытным путём состав:
а) серной кислоты;
Для идентификации серной кислоты ($H_2SO_4$) можно провести следующие опыты:
1. Использование индикаторов: при добавлении универсального индикатора или лакмусовой бумаги к раствору серной кислоты, индикатор изменит цвет на красный (или лакмус станет красным), что свидетельствует о кислой среде.
2. Качественная реакция на сульфат-ион ($SO_4^{2-}$): к раствору серной кислоты добавить раствор соли бария, например, хлорида бария ($BaCl_2$). Наблюдается образование белого мелкокристаллического осадка сульфата бария, который не растворяется в сильных кислотах (например, в азотной кислоте).
$BaCl_2 + H_2SO_4 \rightarrow BaSO_4 \downarrow + 2HCl$
Ионное уравнение: $Ba^{2+} + SO_4^{2-} \rightarrow BaSO_4 \downarrow$
Ответ: Белый осадок сульфата бария при добавлении хлорида бария и изменение цвета индикатора на красный.
б) хлорида железа(III).
Для идентификации хлорида железа(III) ($FeCl_3$) можно провести следующие опыты:
1. Идентификация катиона железа(III) ($Fe^{3+}$): к раствору хлорида железа(III) (который обычно имеет желто-коричневый цвет) добавить раствор щелочи (например, гидроксида натрия, $NaOH$). Наблюдается образование красно-бурого студенистого осадка гидроксида железа(III).
$FeCl_3 + 3NaOH \rightarrow Fe(OH)_3 \downarrow + 3NaCl$
Ионное уравнение: $Fe^{3+} + 3OH^- \rightarrow Fe(OH)_3 \downarrow$
2. Качественная реакция на хлорид-ион ($Cl^-$): к раствору хлорида железа(III) добавить раствор нитрата серебра ($AgNO_3$). Наблюдается образование белого творожистого осадка хлорида серебра, который не растворяется в азотной кислоте, но растворяется в растворе аммиака.
$FeCl_3 + 3AgNO_3 \rightarrow Fe(NO_3)_3 + 3AgCl \downarrow$
Ионное уравнение: $Ag^+ + Cl^- \rightarrow AgCl \downarrow$
Ответ: Образование красно-бурого осадка гидроксида железа(III) при добавлении щелочи и белого творожистого осадка хлорида серебра при добавлении нитрата серебра.
2. Гидролиз солей. Испытайте растворы хлорида калия, карбоната калия и хлорида цинка раствором индикатора или индикаторной бумагой и объясните результаты испытаний. Запишите молекулярные и ионные уравнения реакций гидролиза.
хлорида калия
Хлорид калия ($KCl$) является солью, образованной сильным основанием ($KOH$) и сильной кислотой ($HCl$). Ионы $K^+$ и $Cl^-$ не взаимодействуют с водой, то есть не подвергаются гидролизу. Следовательно, раствор хлорида калия будет иметь нейтральную среду (pH $\approx 7$). При испытании индикаторной бумагой или универсальным индикатором цвет не изменится (например, лакмус останется фиолетовым, метилоранж оранжевым, фенолфталеин бесцветным).
Молекулярное уравнение гидролиза: Гидролиз не происходит.
Ионное уравнение гидролиза: Гидролиз не происходит.
Ответ: Раствор хлорида калия имеет нейтральную среду (pH $\approx 7$), гидролиз не происходит.
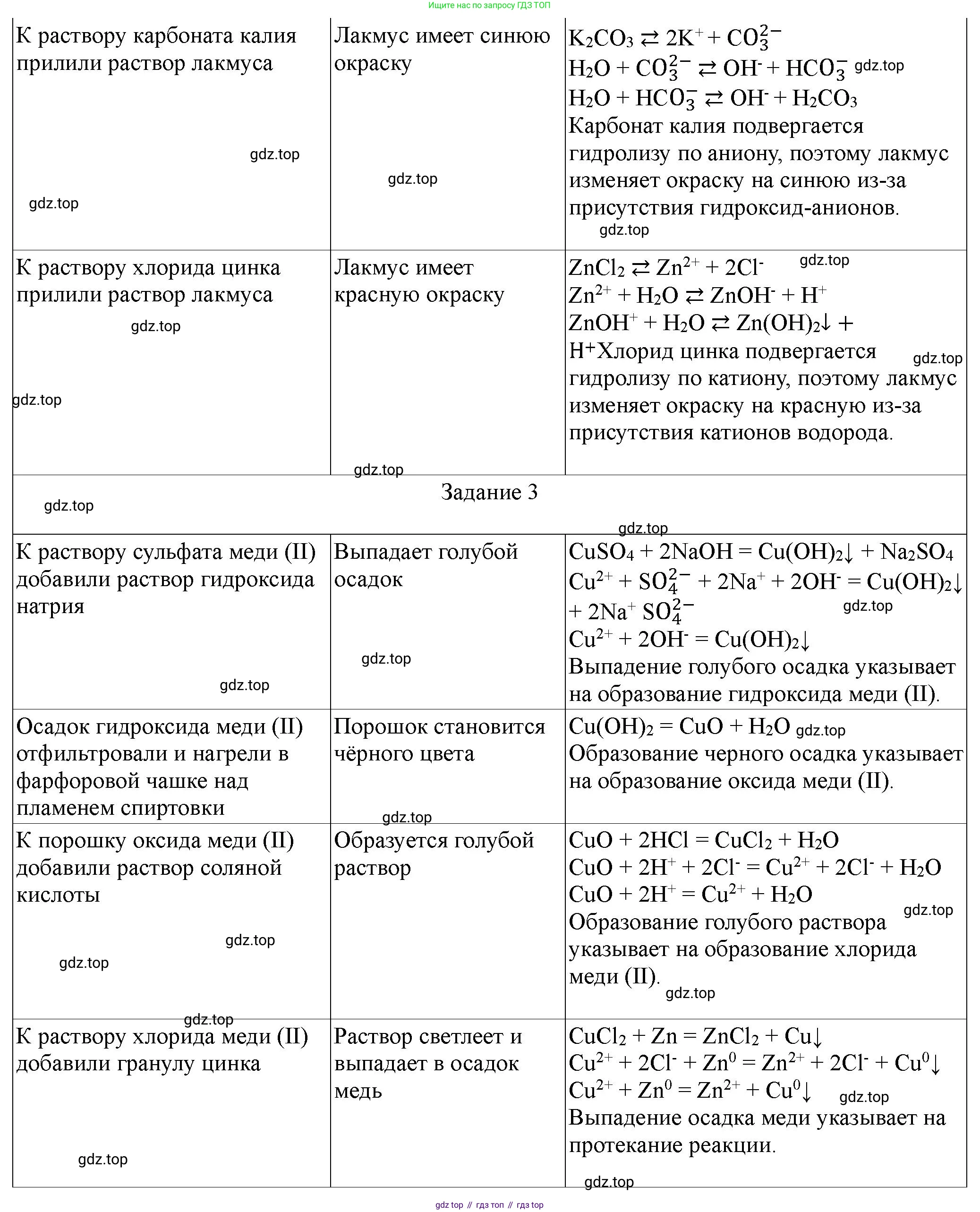
карбоната калия
Карбонат калия ($K_2CO_3$) является солью, образованной сильным основанием ($KOH$) и слабой кислотой ($H_2CO_3$). Гидролиз происходит по аниону ($CO_3^{2-}$). В результате гидролиза образуются гидроксид-ионы ($OH^-$), что приводит к щелочной среде раствора (pH $> 7$). При испытании индикаторной бумагой или универсальным индикатором наблюдается изменение цвета, характерное для щелочной среды (например, лакмус станет синим, фенолфталеин малиновым, метилоранж желтым).
Молекулярное уравнение гидролиза (по первой ступени): $K_2CO_3 + H_2O \rightleftharpoons KHCO_3 + KOH$
Ионное уравнение гидролиза (сокращенное): $CO_3^{2-} + H_2O \rightleftharpoons HCO_3^- + OH^-$
Ответ: Раствор карбоната калия имеет щелочную среду (pH $> 7$), гидролиз происходит по аниону ($CO_3^{2-}$).
хлорида цинка
Хлорид цинка ($ZnCl_2$) является солью, образованной слабым основанием ($Zn(OH)_2$) и сильной кислотой ($HCl$). Гидролиз происходит по катиону ($Zn^{2+}$). В результате гидролиза образуются ионы водорода ($H^+$), что приводит к кислой среде раствора (pH $< 7$). При испытании индикаторной бумагой или универсальным индикатором наблюдается изменение цвета, характерное для кислой среды (например, лакмус станет красным, метилоранж красным, фенолфталеин останется бесцветным).
Молекулярное уравнение гидролиза (по первой ступени): $ZnCl_2 + H_2O \rightleftharpoons Zn(OH)Cl + HCl$
Ионное уравнение гидролиза (сокращенное): $Zn^{2+} + H_2O \rightleftharpoons Zn(OH)^+ + H^+$
Ответ: Раствор хлорида цинка имеет кислую среду (pH $< 7$), гидролиз происходит по катиону ($Zn^{2+}$).
3. Последовательные превращения химических веществ. Осуществите на практике следующие превращения:
$CuSO_4 \rightarrow Cu(OH)_2 \rightarrow CuO \rightarrow CuCl_2 \rightarrow Cu$
1. Получение гидроксида меди(II) из сульфата меди(II):
К водному раствору сульфата меди(II) ($CuSO_4$, медный купорос) приливают раствор щелочи, например, гидроксида натрия ($NaOH$), до выпадения голубого осадка гидроксида меди(II) ($Cu(OH)_2$).
$CuSO_4 + 2NaOH \rightarrow Cu(OH)_2 \downarrow + Na_2SO_4$
2. Получение оксида меди(II) из гидроксида меди(II):
Полученный голубой осадок гидроксида меди(II) отфильтровывают и осторожно нагревают. При нагревании он разлагается, превращаясь в черный оксид меди(II) ($CuO$) и воду.
$Cu(OH)_2 \xrightarrow{t} CuO + H_2O$
3. Получение хлорида меди(II) из оксида меди(II):
К черному оксиду меди(II) ($CuO$) добавляют соляную кислоту ($HCl$). При нагревании (если реакция не идет активно при комнатной температуре) происходит растворение оксида с образованием раствора хлорида меди(II) ($CuCl_2$), имеющего характерный сине-зеленый цвет.
$CuO + 2HCl \rightarrow CuCl_2 + H_2O$
4. Получение меди из хлорида меди(II):
В полученный раствор хлорида меди(II) помещают более активный металл, например, железную пластинку или цинковую гранулу. Происходит реакция замещения, в результате которой на поверхности активного металла выделяется чистая медь в виде красного налета.
$CuCl_2 + Fe \rightarrow FeCl_2 + Cu \downarrow$
Ответ: Последовательность химических реакций, позволяющая осуществить данные превращения, описана выше с соответствующими уравнениями.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения Вариант 1 расположенного на странице 100 к Тетрадь для лабораторных опытов и практических работ 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Вариант 1 (с. 100), авторов: Габриелян (Олег Саргисович), Аксенова (Инна Васильевна), Остроумов (Игорь Геннадьевич), ФГОС (старый) учебного пособия издательства Просвещение.















