Вариант 2, страница 100 - гдз по химии 9 класс тетрадь для лабораторных опытов и практических работ Габриелян, Аксенова

Авторы: Габриелян О. С., Аксенова И. В., Остроумов И. Г.
Тип: Тетрадь для лабораторных опытов и практических работ
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, синий
ISBN: 978-5-09-072533-0
Популярные ГДЗ в 9 классе
Решение экспериментальных задач по теме «Теория электролитической диссоциации». Практическая работа 1 - страница 100.
Вариант 2 (с. 100)
Условие. Вариант 2 (с. 100)
скриншот условия



Вариант 2
1. Идентификация вещества. Докажите опытным путём состав:
а) гидроксида кальция;
б) сульфата аммония.
2. Гидролиз солей. Испытайте растворы нитрата натрия, карбоната натрия и нитрата цинка растворной бумагой и объясните результаты испытаний. Запишите молекулярные и ионные уравнения реакций гидролиза.
3. Последовательные превращения химических веществ. Экспериментально осуществите следующие превращения:
$ \text{Fe} \to \text{FeSO}_4 \to \text{Fe(OH)}_2 \to \text{FeCl}_2 \to \text{Fe(NO}_3)_2 $
Оформите отчёт о проведённой работе в виде таблицы. Укажите условия проведения реакций. Запишите уравнения реакций с участием электролитов в молекулярной и ионной форме. Реакции с участием простых веществ рассмотрите как окислительно-восстановительные.
Что делали
Что наблюдали (рисунок)
Выводы и уравнения химических реакций в молекулярной и ионной форме
Задание 1
Продолжение
Что делали
Что наблюдали (рисунок)
Выводы и уравнения химических реакций в молекулярной и ионной форме
Задание 2
Продолжение
Что делали
Что наблюдали (рисунок)
Выводы и уравнения химических реакций в молекулярной и ионной форме
Задание 3
Решение. Вариант 2 (с. 100)
Решение 2. Вариант 2 (с. 100)
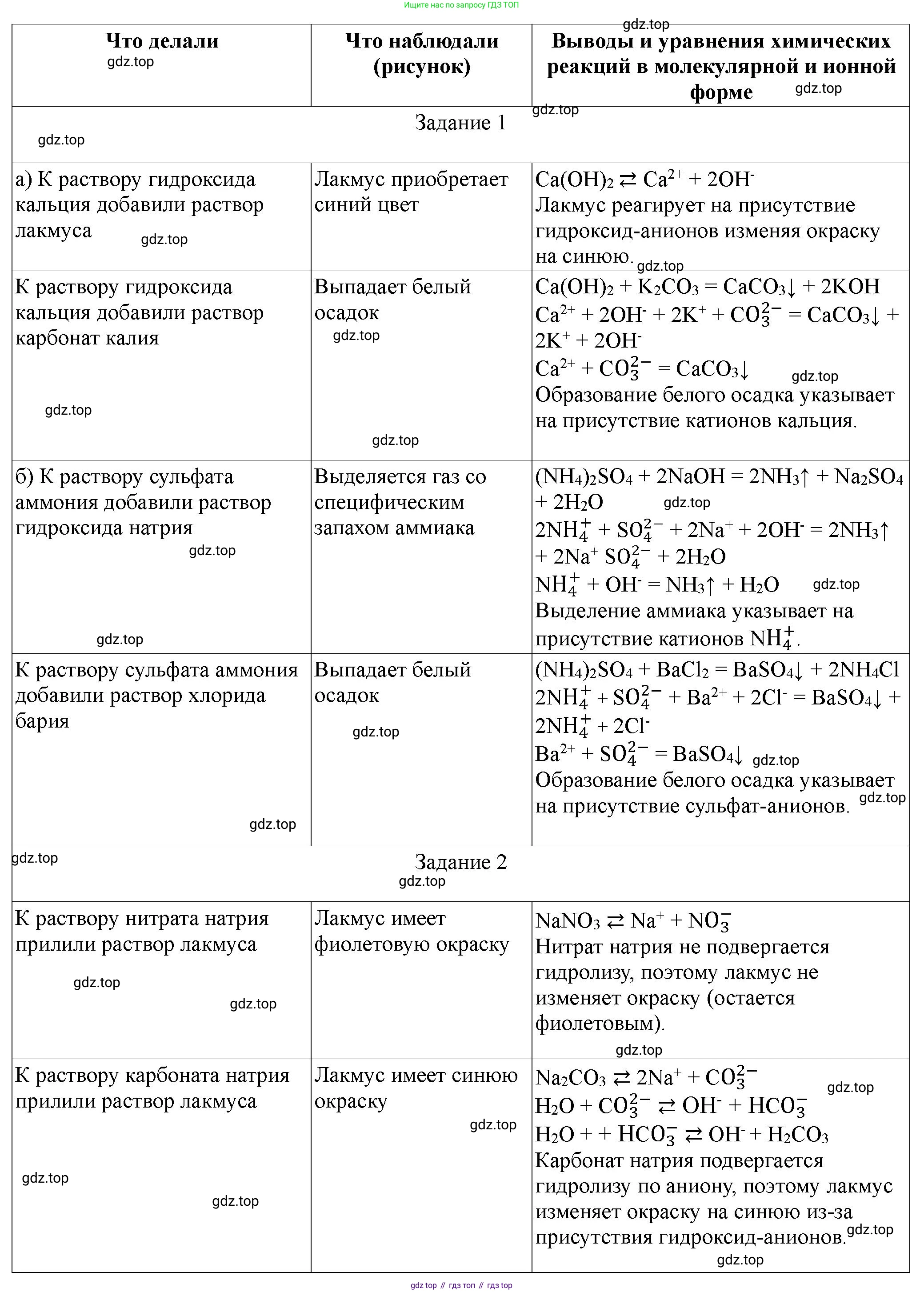
1. Идентификация веществ.
а) гидроксида кальция
Что делали: Приготовить водный раствор исследуемого вещества. Разделить раствор на две части. В одну часть добавить несколько капель фенолфталеина или опустить универсальную индикаторную бумажку. Во вторую часть добавить несколько капель раствора карбоната натрия ($Na_2CO_3$).
Что наблюдали: В первой пробирке фенолфталеин окрасился в малиновый цвет (или универсальная индикаторная бумажка показала щелочную среду). Во второй пробирке образовался белый студенистый осадок.
Выводы и уравнения химических реакций в молекулярной и ионной форме:
Фенолфталеин указывает на присутствие гидроксид-ионов ($OH^-$), что характерно для сильного основания, такого как гидроксид кальция. $Ca(OH)_2(р-р) \rightleftharpoons Ca^{2+}(р-р) + 2OH^-(р-р)$
Реакция с карбонатом натрия подтверждает наличие ионов кальция ($Ca^{2+}$), образующих нерастворимый карбонат кальция.
Молекулярное уравнение: $Ca(OH)_2 + Na_2CO_3 \rightarrow CaCO_3 \downarrow + 2NaOH$
Ионное уравнение: $Ca^{2+} + 2OH^- + 2Na^+ + CO_3^{2-} \rightarrow CaCO_3 \downarrow + 2Na^+ + 2OH^-$
Сокращенное ионное уравнение: $Ca^{2+} + CO_3^{2-} \rightarrow CaCO_3 \downarrow$
б) сульфата аммония
Что делали: Приготовить водный раствор исследуемого вещества. Разделить раствор на две части. В одну часть добавить раствор гидроксида натрия ($NaOH$) и нагреть. Во вторую часть добавить раствор хлорида бария ($BaCl_2$).
Что наблюдали: При нагревании первой пробирки почувствовался резкий запах аммиака. При поднесении влажной красной лакмусовой бумажки к отверстию пробирки, она посинела. Во второй пробирке образовался белый мелкокристаллический осадок, нерастворимый в кислотах.
Выводы и уравнения химических реакций в молекулярной и ионной форме:
Выделение аммиака при нагревании с щелочью свидетельствует о присутствии ионов аммония ($NH_4^+$).
Молекулярное уравнение: $(NH_4)_2SO_4 + 2NaOH \xrightarrow{t} 2NH_3 \uparrow + Na_2SO_4 + 2H_2O$
Ионное уравнение: $2NH_4^+ + SO_4^{2-} + 2Na^+ + 2OH^- \xrightarrow{t} 2NH_3 \uparrow + 2Na^+ + SO_4^{2-} + 2H_2O$
Сокращенное ионное уравнение: $NH_4^+ + OH^- \xrightarrow{t} NH_3 \uparrow + H_2O$
Образование белого осадка с хлоридом бария, нерастворимого в кислотах, указывает на присутствие сульфат-ионов ($SO_4^{2-}$).
Молекулярное уравнение: $(NH_4)_2SO_4 + BaCl_2 \rightarrow BaSO_4 \downarrow + 2NH_4Cl$
Ионное уравнение: $2NH_4^+ + SO_4^{2-} + Ba^{2+} + 2Cl^- \rightarrow BaSO_4 \downarrow + 2NH_4^+ + 2Cl^-$
Сокращенное ионное уравнение: $Ba^{2+} + SO_4^{2-} \rightarrow BaSO_4 \downarrow$
2. Гидролиз солей.
Что делали: Приготовить водные растворы нитрата натрия ($NaNO_3$), карбоната натрия ($Na_2CO_3$) и нитрата цинка ($Zn(NO_3)_2$). В каждую пробирку с раствором опустить универсальную индикаторную бумагу (или добавить соответствующий индикатор).
Что наблюдали: Раствор нитрата натрия ($NaNO_3$): индикаторная бумага не изменила цвет (pH $\approx 7$). Раствор карбоната натрия ($Na_2CO_3$): индикаторная бумага окрасилась в синий/зеленый цвет (pH $> 7$, щелочная среда). Раствор нитрата цинка ($Zn(NO_3)_2$): индикаторная бумага окрасилась в красный/оранжевый цвет (pH $< 7$, кислая среда).
Выводы и уравнения химических реакций в молекулярной и ионной форме:
1) Нитрат натрия ($NaNO_3$):
Соль образована сильным основанием ($NaOH$) и сильной кислотой ($HNO_3$). Гидролиз не происходит, так как ни катион, ни анион не взаимодействуют с водой. Среда нейтральная.
Молекулярное уравнение: $NaNO_3 + H_2O \not\leftrightarrow$ (гидролиз не идет)
Ионное уравнение: $Na^+(р-р) + NO_3^-(р-р) + H_2O \not\leftrightarrow$
2) Карбонат натрия ($Na_2CO_3$):
Соль образована сильным основанием ($NaOH$) и слабой кислотой ($H_2CO_3$). Гидролиз протекает по аниону ($CO_3^{2-}$), вызывая образование гидроксид-ионов ($OH^-$), что приводит к щелочной среде.
Молекулярное уравнение (первая ступень): $Na_2CO_3 + H_2O \rightleftharpoons NaHCO_3 + NaOH$
Ионное уравнение (первая ступень): $CO_3^{2-} + H_2O \rightleftharpoons HCO_3^- + OH^-$
Молекулярное уравнение (вторая ступень, незначительная): $NaHCO_3 + H_2O \rightleftharpoons H_2CO_3 + NaOH$
Ионное уравнение (вторая ступень): $HCO_3^- + H_2O \rightleftharpoons H_2CO_3 + OH^-$
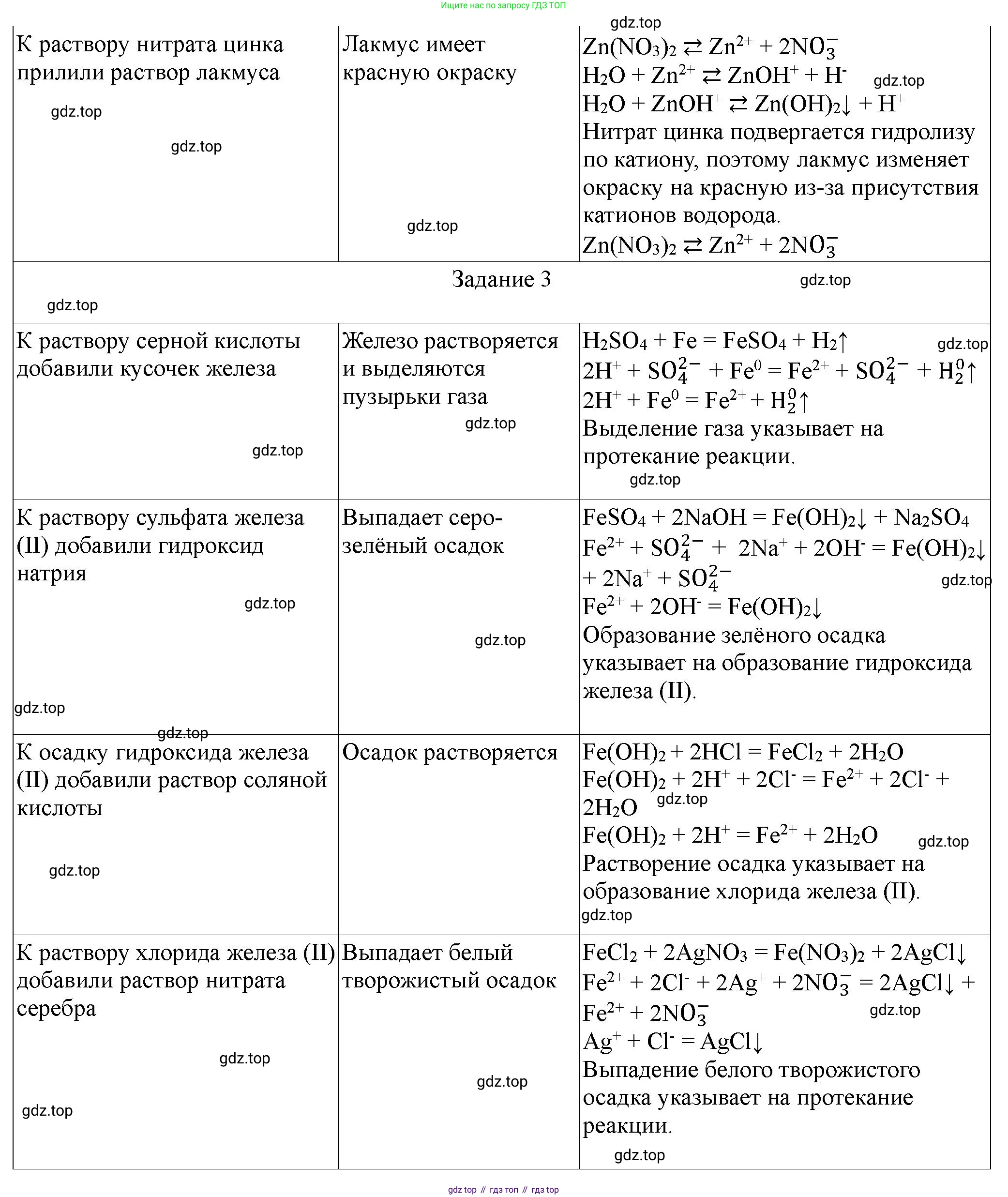
3) Нитрат цинка ($Zn(NO_3)_2$):
Соль образована слабым основанием ($Zn(OH)_2$) и сильной кислотой ($HNO_3$). Гидролиз протекает по катиону ($Zn^{2+}$), вызывая образование ионов водорода ($H^+$), что приводит к кислой среде.
Молекулярное уравнение (первая ступень): $Zn(NO_3)_2 + H_2O \rightleftharpoons ZnOHNO_3 + HNO_3$
Ионное уравнение (первая ступень): $Zn^{2+} + H_2O \rightleftharpoons ZnOH^+ + H^+$
Молекулярное уравнение (вторая ступень, незначительная): $ZnOHNO_3 + H_2O \rightleftharpoons Zn(OH)_2 \downarrow + HNO_3$
Ионное уравнение (вторая ступень): $ZnOH^+ + H_2O \rightleftharpoons Zn(OH)_2 \downarrow + H^+$
3. Последовательные превращения химических веществ.
Превращения: $Fe \rightarrow FeSO_4 \rightarrow Fe(OH)_2 \rightarrow FeCl_2 \rightarrow Fe(NO_3)_2$
1) $Fe \rightarrow FeSO_4$
Что делали: В пробирку с железными опилками или гранулами прилили раствор серной кислоты ($H_2SO_4$) концентрацией 1:2.
Условия проведения реакции: Реакция протекает при комнатной температуре.
Что наблюдали: На поверхности железа образовались пузырьки газа (водорода), железо постепенно растворяется, раствор приобретает бледно-зеленый цвет.
Выводы и уравнения химических реакций в молекулярной и ионной форме:
Молекулярное уравнение: $Fe + H_2SO_4 \rightarrow FeSO_4 + H_2 \uparrow$
Полное ионное уравнение: $Fe + 2H^+ + SO_4^{2-} \rightarrow Fe^{2+} + SO_4^{2-} + H_2 \uparrow$
Сокращенное ионное уравнение: $Fe + 2H^+ \rightarrow Fe^{2+} + H_2 \uparrow$
Эта реакция является окислительно-восстановительной, так как происходит изменение степеней окисления элементов:
Восстановитель: $Fe^0 - 2e^- \rightarrow Fe^{2+}$ (окисление)
Окислитель: $2H^+ + 2e^- \rightarrow H_2^0$ (восстановление)
2) $FeSO_4 \rightarrow Fe(OH)_2$
Что делали: К полученному раствору сульфата железа(II) прилили раствор гидроксида натрия ($NaOH$).
Условия проведения реакции: Реакция протекает при комнатной температуре. Для получения чистого гидроксида железа(II) желательно исключить доступ кислорода воздуха.
Что наблюдали: Образовался белый студенистый осадок, который на воздухе быстро темнеет, приобретая зеленоватый, а затем бурый цвет (из-за окисления кислородом воздуха до $Fe(OH)_3$).
Выводы и уравнения химических реакций в молекулярной и ионной форме:
Молекулярное уравнение: $FeSO_4 + 2NaOH \rightarrow Fe(OH)_2 \downarrow + Na_2SO_4$
Полное ионное уравнение: $Fe^{2+} + SO_4^{2-} + 2Na^+ + 2OH^- \rightarrow Fe(OH)_2 \downarrow + 2Na^+ + SO_4^{2-}$
Сокращенное ионное уравнение: $Fe^{2+} + 2OH^- \rightarrow Fe(OH)_2 \downarrow$
3) $Fe(OH)_2 \rightarrow FeCl_2$
Что делали: К полученному осадку гидроксида железа(II) прилили избыток разбавленной соляной кислоты ($HCl$).
Условия проведения реакции: Реакция протекает при комнатной температуре.
Что наблюдали: Белый осадок гидроксида железа(II) растворился, образовав прозрачный бледно-зеленый раствор.
Выводы и уравнения химических реакций в молекулярной и ионной форме:
Молекулярное уравнение: $Fe(OH)_2 + 2HCl \rightarrow FeCl_2 + 2H_2O$
Полное ионное уравнение: $Fe(OH)_2 + 2H^+ + 2Cl^- \rightarrow Fe^{2+} + 2Cl^- + 2H_2O$
Сокращенное ионное уравнение: $Fe(OH)_2 + 2H^+ \rightarrow Fe^{2+} + 2H_2O$
4) $FeCl_2 \rightarrow Fe(NO_3)_2$
Что делали: К раствору хлорида железа(II) ($FeCl_2$) прилили раствор нитрата серебра ($AgNO_3$) до полного осаждения хлорид-ионов. Полученный осадок отфильтровали.
Условия проведения реакции: Реакция протекает при комнатной температуре.
Что наблюдали: Образовался белый творожистый осадок, который постепенно темнеет на свету. Фильтрат представляет собой бледно-зеленый раствор нитрата железа(II).
Выводы и уравнения химических реакций в молекулярной и ионной форме:
Молекулярное уравнение: $FeCl_2 + 2AgNO_3 \rightarrow Fe(NO_3)_2 + 2AgCl \downarrow$
Полное ионное уравнение: $Fe^{2+} + 2Cl^- + 2Ag^+ + 2NO_3^- \rightarrow Fe^{2+} + 2NO_3^- + 2AgCl \downarrow$
Сокращенное ионное уравнение: $2Cl^- + 2Ag^+ \rightarrow 2AgCl \downarrow$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения Вариант 2 расположенного на странице 100 к Тетрадь для лабораторных опытов и практических работ 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Вариант 2 (с. 100), авторов: Габриелян (Олег Саргисович), Аксенова (Инна Васильевна), Остроумов (Игорь Геннадьевич), ФГОС (старый) учебного пособия издательства Просвещение.















