Номер 4, страница 104 - гдз по химии 9 класс тетрадь для лабораторных опытов и практических работ Габриелян, Аксенова

Авторы: Габриелян О. С., Аксенова И. В., Остроумов И. Г.
Тип: Тетрадь для лабораторных опытов и практических работ
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, синий
ISBN: 978-5-09-072533-0
Популярные ГДЗ в 9 классе
Изучение свойств соляной кислоты. Практическая работа 2 - номер 4, страница 104.
№4 (с. 104)
Условие. №4 (с. 104)
скриншот условия

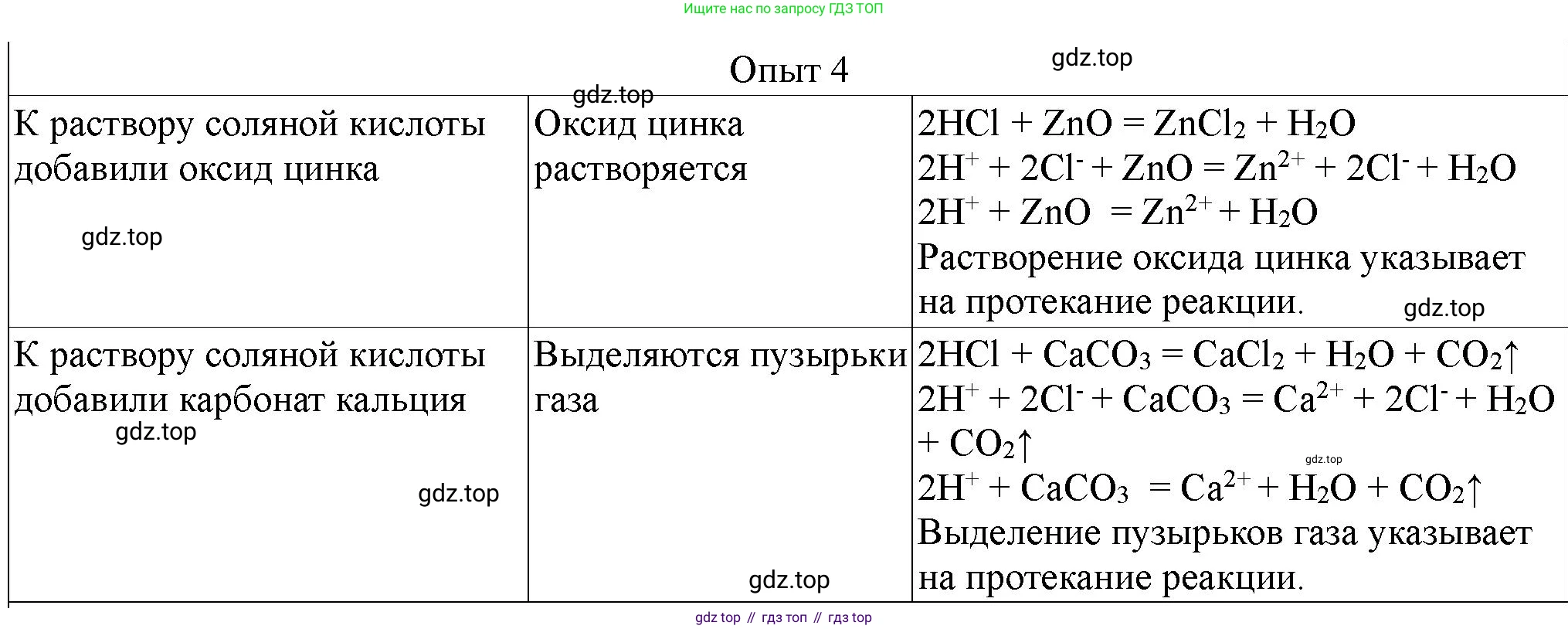
4. В две пробирки налейте по 1—2 мл соляной кислоты. В первую добавьте на кончике шпателя оксид цинка, во вторую — кусочек карбоната кальция (мела или мрамора). Объясните результаты. Напишите молекулярные и сокращённые ионные уравнения реакций.
Решение. №4 (с. 104)
Решение 2. №4 (с. 104)
Решение
Обоснование результатов
В первой пробирке оксид цинка ($ZnO$), являющийся амфотерным оксидом, будет реагировать с соляной кислотой ($HCl$), сильной кислотой, образуя растворимую соль (хлорид цинка) и воду. В результате реакции твердый оксид цинка растворится, образуя прозрачный раствор.
Во второй пробирке карбонат кальция ($CaCO_3$), соль слабой угольной кислоты, будет реагировать с соляной кислотой ($HCl$), сильной кислотой. В результате этой реакции образуется хлорид кальция, вода и углекислый газ. Выделение углекислого газа будет наблюдаться в виде бурного выделения пузырьков (вскипания).
Ответ: В первой пробирке оксид цинка растворяется, во второй пробирке карбонат кальция растворяется с выделением газа.
Молекулярные уравнения реакций
Реакция в первой пробирке (соляная кислота и оксид цинка):
$ZnO(s) + 2HCl(aq) \rightarrow ZnCl_2(aq) + H_2O(l)$
Реакция во второй пробирке (соляная кислота и карбонат кальция):
$CaCO_3(s) + 2HCl(aq) \rightarrow CaCl_2(aq) + H_2O(l) + CO_2(g)$
Ответ: Уравнения приведены выше.
Сокращенные ионные уравнения реакций
Для первой пробирки ($ZnO + HCl$):
Молекулярное уравнение: $ZnO(s) + 2HCl(aq) \rightarrow ZnCl_2(aq) + H_2O(l)$
Полное ионное уравнение: $ZnO(s) + 2H^+(aq) + 2Cl^-(aq) \rightarrow Zn^{2+}(aq) + 2Cl^-(aq) + H_2O(l)$
Сокращенное ионное уравнение: $ZnO(s) + 2H^+(aq) \rightarrow Zn^{2+}(aq) + H_2O(l)$
Для второй пробирки ($CaCO_3 + HCl$):
Молекулярное уравнение: $CaCO_3(s) + 2HCl(aq) \rightarrow CaCl_2(aq) + H_2O(l) + CO_2(g)$
Полное ионное уравнение: $CaCO_3(s) + 2H^+(aq) + 2Cl^-(aq) \rightarrow Ca^{2+}(aq) + 2Cl^-(aq) + H_2O(l) + CO_2(g)$
Сокращенное ионное уравнение: $CaCO_3(s) + 2H^+(aq) \rightarrow Ca^{2+}(aq) + H_2O(l) + CO_2(g)$
Ответ: Уравнения приведены выше.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 4 расположенного на странице 104 к Тетрадь для лабораторных опытов и практических работ 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 104), авторов: Габриелян (Олег Саргисович), Аксенова (Инна Васильевна), Остроумов (Игорь Геннадьевич), ФГОС (старый) учебного пособия издательства Просвещение.















