Номер 3, страница 37 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 2. Химические реакции в водных растворах. Параграф 9. Реакции ионного обмена. Тестовые задания - номер 3, страница 37.
№3 (с. 37)
Условие. №3 (с. 37)
скриншот условия

3. Реакции, схема которой
$K_2CO_3 + HNO_3 \rightarrow KNO_3 + H_2O + CO_2\uparrow$
соответствует сокращённое ионное уравнение
1) $H^+ + OH^- = H_2O$
2) $CO_3^{2-} + 2H^+ = H_2O + CO_2\uparrow$
3) $H_2O + CO_2 = 2H^+ + CO_3^{2-}$
4) $K_2CO_3 = 2K^+ + CO_3^{2-}$
Решение. №3 (с. 37)
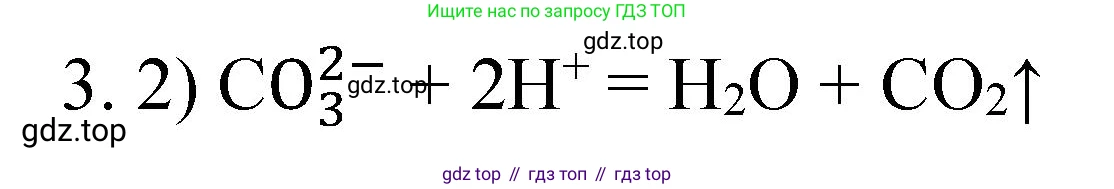
Решение 2. №3 (с. 37)
Решение
Для того чтобы определить, какое сокращённое ионное уравнение соответствует предложенной реакции, необходимо выполнить несколько последовательных шагов.
1. Составление сбалансированного молекулярного уравнения
Исходная схема реакции: $K_2CO_3 + HNO_3 \rightarrow KNO_3 + H_2O + CO_2\uparrow$.
Чтобы уравнять количество атомов каждого элемента в левой и правой частях, нужно расставить коэффициенты. В левой части 2 атома калия (K), поэтому в правой части перед нитратом калия ($KNO_3$) ставим коэффициент 2. В результате в правой части стало 2 нитрат-иона ($NO_3^-$), значит, в левой части перед азотной кислотой ($HNO_3$) также необходимо поставить коэффициент 2.
Получаем сбалансированное молекулярное уравнение:
$K_2CO_3 + 2HNO_3 \rightarrow 2KNO_3 + H_2O + CO_2\uparrow$
2. Запись полного ионного уравнения
В полном ионном уравнении сильные электролиты (растворимые соли, сильные кислоты и щёлочи) записываются в виде ионов, на которые они диссоциируют в водном растворе. Слабые электролиты (например, вода), газы и нерастворимые вещества (осадки) записываются в молекулярной форме.
$K_2CO_3$ (карбонат калия) — растворимая соль, является сильным электролитом: $K_2CO_3 \rightarrow 2K^+ + CO_3^{2-}$.
$HNO_3$ (азотная кислота) — сильная кислота, сильный электролит: $HNO_3 \rightarrow H^+ + NO_3^-$.
$KNO_3$ (нитрат калия) — растворимая соль, сильный электролит: $KNO_3 \rightarrow K^+ + NO_3^-$.
$H_2O$ (вода) — слабый электролит, записывается в молекулярном виде.
$CO_2$ (оксид углерода(IV)) — газ, выделяющийся из раствора, записывается в молекулярном виде.
С учётом стехиометрических коэффициентов, полное ионное уравнение имеет вид:
$2K^+ + CO_3^{2-} + 2H^+ + 2NO_3^- \rightarrow 2K^+ + 2NO_3^- + H_2O + CO_2\uparrow$
3. Составление сокращённого ионного уравнения
Сокращённое ионное уравнение получается путём исключения из обеих частей полного ионного уравнения ионов, которые не участвуют в реакции (ионы-наблюдатели). В данном случае это катионы калия ($K^+$) и нитрат-анионы ($NO_3^-$).
$\cancel{2K^+} + CO_3^{2-} + 2H^+ + \cancel{2NO_3^-} \rightarrow \cancel{2K^+} + \cancel{2NO_3^-} + H_2O + CO_2\uparrow$
После сокращения ионов-наблюдателей получаем итоговое уравнение, которое отражает сущность химического взаимодействия:
$CO_3^{2-} + 2H^+ = H_2O + CO_2\uparrow$
Сравнивая полученное сокращённое ионное уравнение с предложенными вариантами, видим, что оно соответствует варианту 2.
Ответ: 2
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 3 расположенного на странице 37 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 37), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















