Практическая работа 4, страница 79 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 4. Кислород и сера. Параграф 22. Практическая работа 4. Решение экспериментальных задач по теме "Кислород и сера" - страница 79.
Практическая работа 4 (с. 79)
Условие. Практическая работа 4 (с. 79)
скриншот условия

● Вспомните правила техники безопасности при работе в химическом кабинете.
● Составьте план работы.
● Определите перечень необходимых реактивов и оборудования.
Для решения задачи берите не всё вещество, а порцию (пробу) — примерно $1 \text{ см}^3$.
Чтобы не перепутать пробы, ставьте пробирки с растворами одну за другой в штатив для пробирок и нумеруйте с помощью специального карандаша.
Задача 1. Даны пробирки с растворами: а) сульфата натрия; б) хлорида натрия; в) серной кислоты. Опытным путём определите, в какой пробирке находится каждое из указанных веществ.
Задача 2. Дан раствор сульфата меди(II). Получите из него раствор хлорида меди(II).
Задача 3. Даны четыре пронумерованные пробирки, в которых находятся следующие соли калия: сульфид, сульфат, сульфит, бромид. Определите при помощи характерных реакций каждое из данных веществ.
Задача 4. Проделайте опыты по осуществлению следующих превращений:
а) $цинк \rightarrow сульфат \ цинка \rightarrow гидроксид \ цинка$
б) $оксид \ меди(II) \rightarrow сульфат \ меди(II) \rightarrow гидроксид \ меди(II)$
Задача 5. Даны вещества: серная кислота, цинк, растворы нитрата стронция, хлорида натрия, хлорида кальция, хлорида меди(II). Проверьте опытным путём, с какими веществами реагирует серная кислота. Почему? Какие реакции относятся к окислительно-восстановительным? Ответ мотивируйте.
Задача 6. Проделайте реакции, подтверждающие качественный состав серной и соляной кислот.
4. Отчёт о работе оформите в виде таблицы (см. § 16).
Решение. Практическая работа 4 (с. 79)

Решение 2. Практическая работа 4 (с. 79)
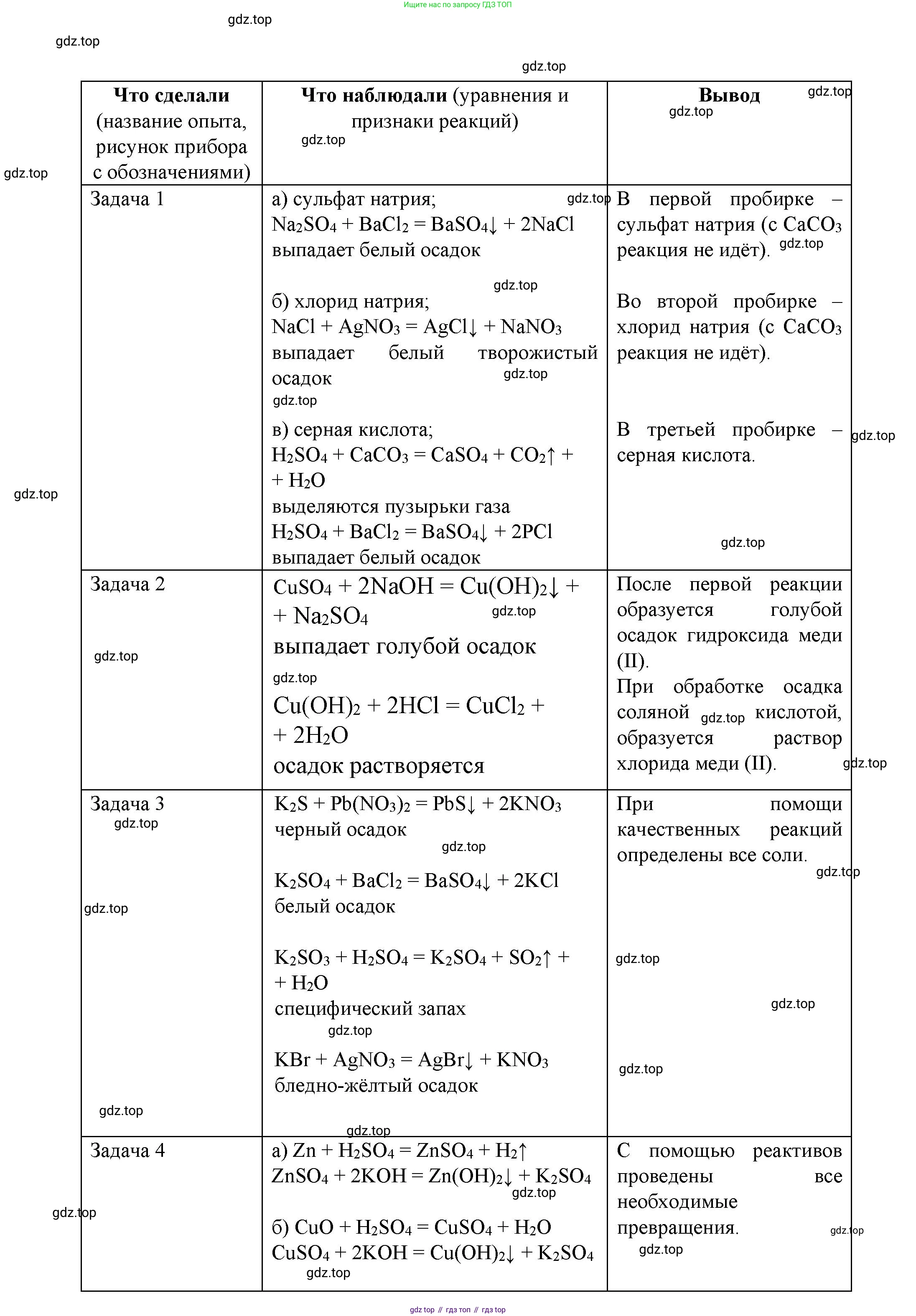
Задача 1.
Решение
Для определения веществ в трёх пронумерованных пробирках, содержащих по условию растворы сульфата натрия ($Na_2SO_4$), хлорида натрия ($NaCl$) и серной кислоты ($H_2SO_4$), следует провести ряд качественных реакций. Порядок действий:
1. Отбираем из каждой пробирки небольшие пробы в три чистые пробирки для анализа.
2. Определение кислоты. В каждую из трёх проб добавляем индикатор, например, лакмус, или опускаем универсальную индикаторную бумагу. В той пробирке, где индикатор изменит цвет на красный, находится серная кислота ($H_2SO_4$). Две другие пробирки содержат растворы солей, которые имеют нейтральную среду ($pH \approx 7$), и цвет индикатора в них не изменится.
3. Определение сульфат-иона. В две оставшиеся пробирки (с $Na_2SO_4$ и $NaCl$) добавляем по несколько капель раствора хлорида бария ($BaCl_2$). В пробирке с сульфатом натрия образуется характерный белый мелкокристаллический осадок сульфата бария ($BaSO_4$).
Уравнение реакции: $Na_2SO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + 2NaCl$
4. Определение хлорида натрия. В пробирке, где при добавлении хлорида бария не произошло видимых изменений, находится раствор хлорида натрия. Для дополнительной проверки можно в новую пробу этого раствора добавить раствор нитрата серебра ($AgNO_3$). Образуется белый творожистый осадок хлорида серебра ($AgCl$).
Уравнение реакции: $NaCl + AgNO_3 \rightarrow AgCl\downarrow + NaNO_3$
Ответ: С помощью индикатора (лакмуса) определяется серная кислота (покраснение). Затем в оставшиеся два раствора добавляется раствор хлорида бария; там, где выпадает белый осадок ($BaSO_4$), — сульфат натрия. В оставшейся пробирке — хлорид натрия.
Задача 2.
Решение
Чтобы получить раствор хлорида меди(II) ($CuCl_2$) из раствора сульфата меди(II) ($CuSO_4$), необходимо провести реакцию ионного обмена, в результате которой сульфат-ионы ($SO_4^{2-}$) будут удалены из раствора в виде нерастворимого соединения. Для этого к раствору сульфата меди(II) нужно прилить раствор растворимого хлорида, катион которого образует с сульфат-ионом осадок. Подходящим реагентом является хлорид бария ($BaCl_2$).
При смешивании растворов сульфата меди(II) и хлорида бария протекает реакция:
$CuSO_4 + BaCl_2 \rightarrow CuCl_2 + BaSO_4\downarrow$
В результате реакции образуется растворимый в воде хлорид меди(II) и нерастворимый белый осадок сульфата бария. Чтобы получить чистый раствор хлорида меди(II), необходимо отделить осадок. Это можно сделать путем фильтрования или декантации (аккуратного сливания раствора с осадка).
Ответ: К раствору сульфата меди(II) необходимо добавить раствор хлорида бария. Выпавший белый осадок сульфата бария следует отделить фильтрованием. Полученный фильтрат является раствором хлорида меди(II).
Задача 3.
Решение
Для определения каждой из солей калия (сульфида $K_2S$, сульфата $K_2SO_4$, сульфита $K_2SO_3$ и бромида $KBr$) в четырёх пронумерованных пробирках необходимо использовать качественные реакции на соответствующие анионы.
1. Отбираем пробы из всех четырех пробирок. В каждую пробу добавляем раствор сильной кислоты, например, соляной ($HCl$).
• В пробирке с сульфидом калия ($K_2S$) будет выделяться газ с запахом тухлых яиц — сероводород ($H_2S$).
$K_2S + 2HCl \rightarrow 2KCl + H_2S\uparrow$
• В пробирке с сульфитом калия ($K_2SO_3$) будет выделяться бесцветный газ с резким запахом — диоксид серы ($SO_2$).
$K_2SO_3 + 2HCl \rightarrow 2KCl + H_2O + SO_2\uparrow$
• В пробирках с сульфатом и бромидом калия видимых изменений не произойдет.
2. В новые пробы из двух оставшихся неопознанными пробирок добавляем раствор хлорида бария ($BaCl_2$).
• В пробирке с сульфатом калия ($K_2SO_4$) выпадет белый осадок сульфата бария ($BaSO_4$), нерастворимый в кислотах.
$K_2SO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + 2KCl$
3. В последней оставшейся пробирке находится бромид калия ($KBr$). Для подтверждения в новую пробу этого раствора можно добавить раствор нитрата серебра ($AgNO_3$).
• Выпадет характерный бледно-жёлтый (кремовый) осадок бромида серебра ($AgBr$).
$KBr + AgNO_3 \rightarrow AgBr\downarrow + KNO_3$
Ответ: Сульфид и сульфит калия определяются по запаху газов ($H_2S$ и $SO_2$), выделяющихся при добавлении кислоты. Сульфат калия определяется по белому осадку с хлоридом бария. Бромид калия определяется по бледно-жёлтому осадку с нитратом серебра.
Задача 4.
Решение
Для осуществления данных цепочек превращений необходимо провести следующие реакции:
а) цинк $\rightarrow$ сульфат цинка $\rightarrow$ гидроксид цинка
1. Получение сульфата цинка из цинка: В пробирку с гранулами цинка ($Zn$) приливаем разбавленный раствор серной кислоты ($H_2SO_4$). Наблюдается выделение пузырьков газа (водорода) и растворение металла.
$Zn + H_2SO_4 \rightarrow ZnSO_4 + H_2\uparrow$
2. Получение гидроксида цинка из сульфата цинка: К полученному раствору сульфата цинка ($ZnSO_4$) по каплям добавляем раствор щёлочи, например, гидроксида натрия ($NaOH$). Образуется белый студенистый осадок гидроксида цинка ($Zn(OH)_2$).
$ZnSO_4 + 2NaOH \rightarrow Zn(OH)_2\downarrow + Na_2SO_4$
б) оксид меди(II) $\rightarrow$ сульфат меди(II) $\rightarrow$ гидроксид меди(II)
1. Получение сульфата меди(II) из оксида меди(II): В пробирку с чёрным порошком оксида меди(II) ($CuO$) приливаем раствор серной кислоты ($H_2SO_4$) и слегка нагреваем. Чёрный порошок растворяется, и образуется раствор голубого цвета — сульфат меди(II) ($CuSO_4$).
$CuO + H_2SO_4 \rightarrow CuSO_4 + H_2O$
2. Получение гидроксида меди(II) из сульфата меди(II): К полученному голубому раствору сульфата меди(II) добавляем раствор щёлочи ($NaOH$). Выпадает голубой студенистый осадок гидроксида меди(II) ($Cu(OH)_2$).
$CuSO_4 + 2NaOH \rightarrow Cu(OH)_2\downarrow + Na_2SO_4$
Ответ: a) На цинк действуем серной кислотой, затем к продукту добавляем гидроксид натрия. б) Оксид меди(II) растворяем в серной кислоте, затем к полученному раствору добавляем гидроксид натрия.
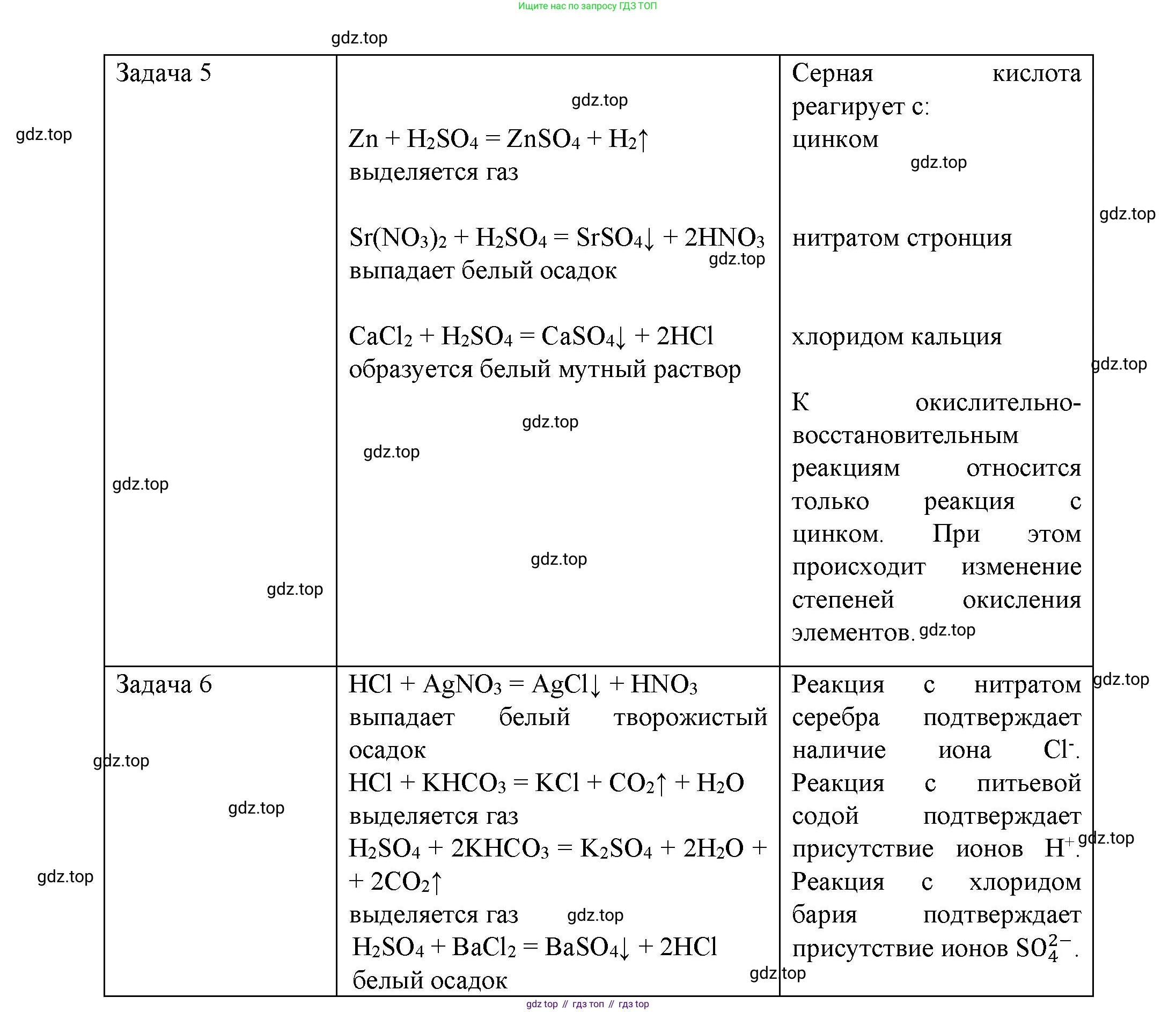
Задача 5.
Решение
Проверим экспериментально, с какими из предложенных веществ реагирует серная кислота ($H_2SO_4$).
1. Цинк ($Zn$): Серная кислота (разбавленная) реагирует с цинком, так как цинк — металл, стоящий в ряду активности до водорода.
$H_2SO_4 + Zn \rightarrow ZnSO_4 + H_2\uparrow$
Почему? Цинк является более активным металлом, чем водород, и вытесняет его из кислоты.
2. Раствор нитрата стронция ($Sr(NO_3)_2$): Серная кислота реагирует с нитратом стронция, так как в результате реакции обмена образуется нерастворимый осадок сульфата стронция ($SrSO_4$).
$H_2SO_4 + Sr(NO_3)_2 \rightarrow SrSO_4\downarrow + 2HNO_3$
Почему? Реакция идет до конца из-за образования осадка (одно из условий протекания реакций ионного обмена).
3. Растворы хлорида натрия ($NaCl$) и хлорида калия ($KCl$): В растворах реакции с разбавленной серной кислотой практически не идут, так как все вещества растворимы и являются сильными электролитами. Однако концентрированная серная кислота реагирует с твёрдыми хлоридами натрия и калия при нагревании, вытесняя летучую соляную кислоту.
$H_2SO_4(\text{конц.}) + 2NaCl(\text{тв.}) \xrightarrow{t} Na_2SO_4 + 2HCl\uparrow$
Почему? Реакция возможна, так как серная кислота является нелетучей и вытесняет летучую соляную кислоту из её солей.
4. Раствор хлорида меди(II) ($CuCl_2$): В растворе серная кислота не реагирует с хлоридом меди(II), так как не выполняется ни одно из условий протекания реакций ионного обмена (не образуется осадок, газ или слабый электролит).
Окислительно-восстановительные реакции:
К окислительно-восстановительным (ОВР) относится реакция, в которой элементы изменяют свои степени окисления. Из перечисленных реакций ОВР является только взаимодействие серной кислоты с цинком.
$H_2\overset{+6}{S}O_4 + \overset{0}{Zn} \rightarrow \overset{+2}{Zn}\overset{+6}{S}O_4 + \overset{0}{H_2}\uparrow$
Здесь цинк ($Zn^0$) окисляется до $Zn^{+2}$, а водород ($H^{+1}$) в кислоте восстанавливается до $H_2^0$. Остальные реакции являются реакциями ионного обмена, где изменения степеней окисления не происходит.
Ответ: Серная кислота реагирует с цинком, нитратом стронция, а также (концентрированная) с твердыми хлоридами натрия и калия. Реакция с цинком относится к окислительно-восстановительным, так как цинк и водород изменяют свои степени окисления. Остальные реакции — ионного обмена, идущие за счет образования осадка или выделения газа.
Задача 6.
Решение
Для подтверждения качественного состава серной ($H_2SO_4$) и соляной ($HCl$) кислот необходимо доказать наличие в них ионов водорода ($H^+$) и соответствующих кислотных остатков — сульфат-ионов ($SO_4^{2-}$) и хлорид-ионов ($Cl^-$).
1. Доказательство наличия ионов водорода ($H^+$), то есть кислотных свойств. Это свойство является общим для обеих кислот.
• Действие на индикаторы: в пробах обеих кислот лакмус станет красным.
• Взаимодействие с активными металлами: при добавлении в пробы кислот гранул цинка в обеих пробирках будет наблюдаться выделение газа водорода.
$2HCl + Zn \rightarrow ZnCl_2 + H_2\uparrow$
$H_2SO_4 + Zn \rightarrow ZnSO_4 + H_2\uparrow$
2. Доказательство наличия сульфат-иона ($SO_4^{2-}$) в серной кислоте.
• Качественной реакцией на сульфат-ион является взаимодействие с растворимыми солями бария. К пробе серной кислоты добавляем несколько капель раствора хлорида бария ($BaCl_2$). Наблюдаем выпадение белого осадка сульфата бария ($BaSO_4$), нерастворимого в других кислотах.
$H_2SO_4 + BaCl_2 \rightarrow BaSO_4\downarrow + 2HCl$
Соляная кислота с хлоридом бария не реагирует.
3. Доказательство наличия хлорид-иона ($Cl^-$) в соляной кислоте.
• Качественной реакцией на хлорид-ион является взаимодействие с раствором нитрата серебра ($AgNO_3$). К пробе соляной кислоты добавляем несколько капель этого раствора. Наблюдаем выпадение белого творожистого осадка хлорида серебра ($AgCl$), нерастворимого в азотной кислоте.
$HCl + AgNO_3 \rightarrow AgCl\downarrow + HNO_3$
Серная кислота с нитратом серебра не реагирует.
Ответ: Качественный состав кислот подтверждается: а) общими кислотными свойствами (реакция с индикаторами, активными металлами), доказывающими наличие ионов $H^+$; б) специфическими реакциями на анионы: для $H_2SO_4$ — образование белого осадка с солями бария, для $HCl$ — образование белого творожистого осадка с нитратом серебра.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения Практическая работа 4 расположенного на странице 79 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Практическая работа 4 (с. 79), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















