Номер 2, страница 148 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 7. Металлы. Параграф 41. Химические свойства металлов. Электрохимический ряд напряжений металлов. Подумай, ответь, выполни... - номер 2, страница 148.
№2 (с. 148)
Условие. №2 (с. 148)
скриншот условия
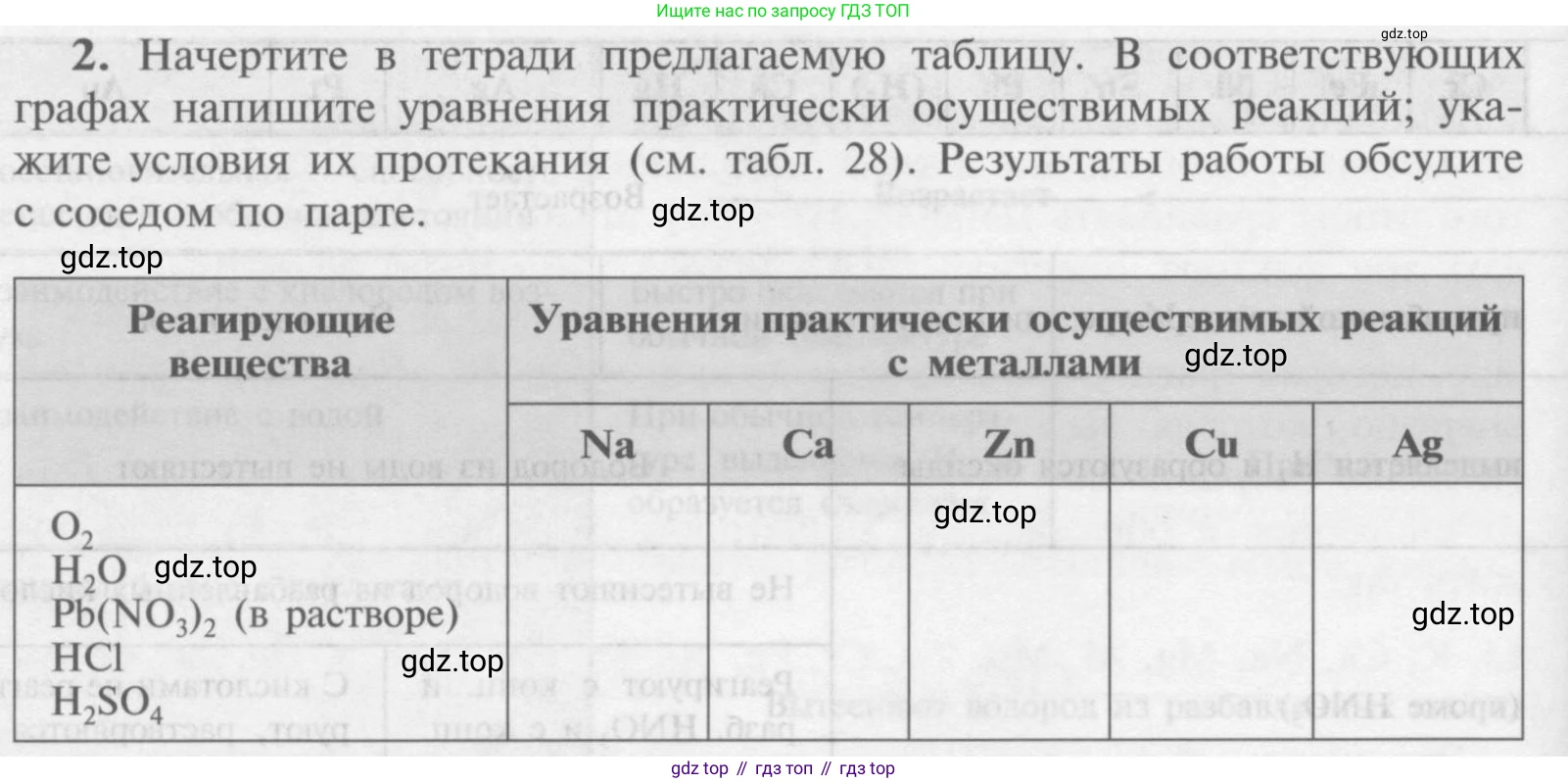
2. Начертите в тетради предлагаемую таблицу. В соответствующих графах напишите уравнения практически осуществимых реакций; укажите условия их протекания (см. табл. 28). Результаты работы обсудите с соседом по парте.
Реагирующие вещества
Уравнения практически осуществимых реакций с металлами
Na
Ca
Zn
Cu
Ag
$O_2$
$H_2O$
$Pb(NO_3)_2$ (в растворе)
$HCl$
$H_2SO_4$
Решение. №2 (с. 148)
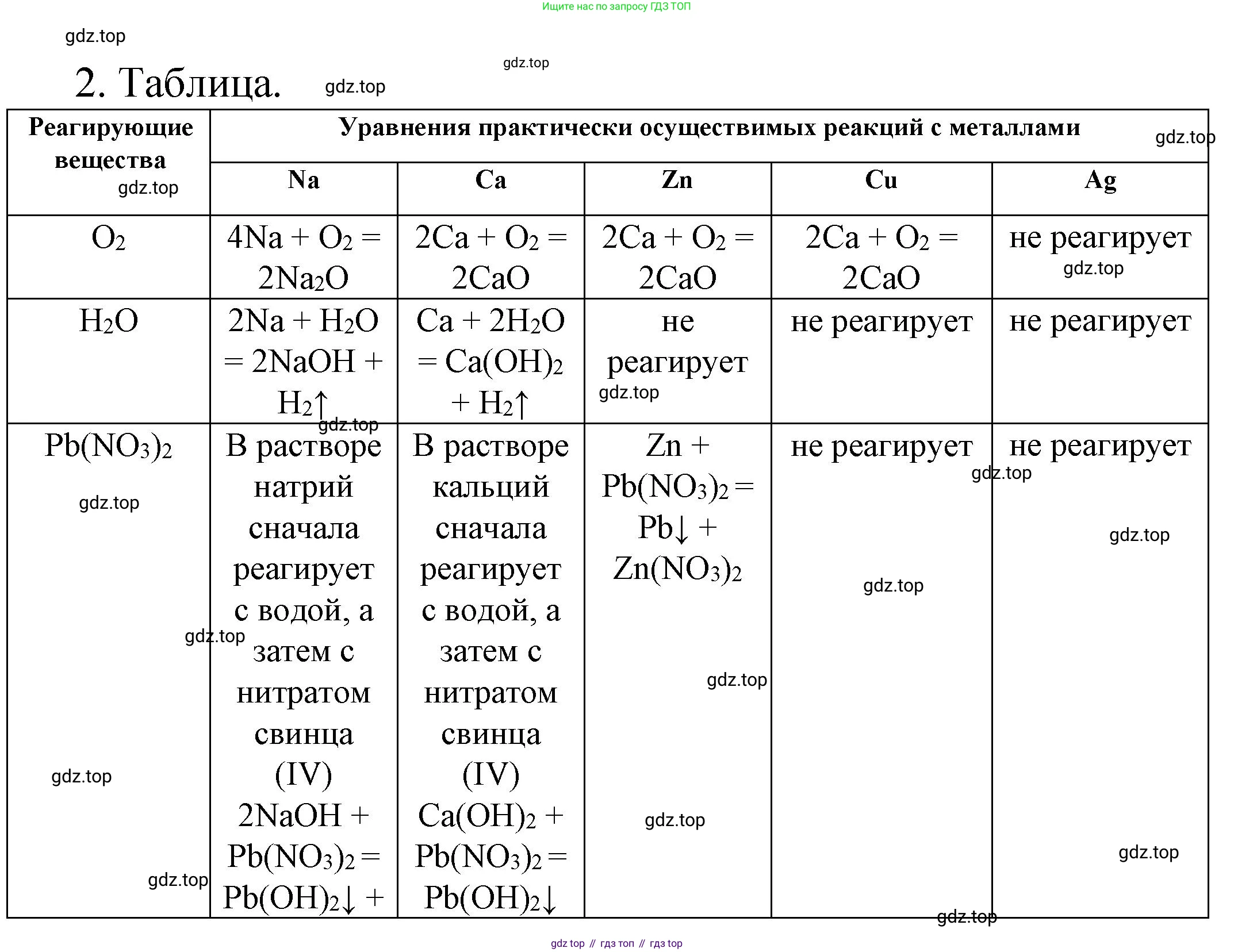
Решение 2. №2 (с. 148)
Для определения возможности протекания реакций будем использовать ряд активности металлов: Na, Ca - очень активные металлы, стоят в начале ряда; Zn - металл средней активности, стоит до водорода; Cu, Ag - малоактивные металлы, стоят после водорода.
O₂
Активные и средней активности металлы окисляются кислородом, как правило, при нагревании. Малоактивные металлы (серебро, золото, платина) с кислородом не реагируют.
Na: Натрий легко окисляется на воздухе. При горении образует пероксид, но в рамках школьного курса чаще записывают реакцию образования оксида.
Уравнение: $4Na + O_2 \xrightarrow{t} 2Na_2O$
Условия: Небольшое нагревание.
Ca: Кальций реагирует с кислородом при нагревании с образованием оксида.
Уравнение: $2Ca + O_2 \xrightarrow{t} 2CaO$
Условия: Нагревание.
Zn: Цинк сгорает в кислороде при сильном нагревании.
Уравнение: $2Zn + O_2 \xrightarrow{t} 2ZnO$
Условия: Сильное нагревание (прокаливание).
Cu: Медь окисляется при нагревании на воздухе.
Уравнение: $2Cu + O_2 \xrightarrow{t} 2CuO$
Условия: Нагревание (400-500°C).
Ag: Серебро — благородный металл, с кислородом не реагирует.
Реакция практически не осуществима.
Ответ: Na, Ca, Zn, Cu реагируют с кислородом при нагревании. Ag не реагирует.
H₂O
Активные металлы (стоящие до Mg в ряду активности) реагируют с водой при обычных условиях. Металлы средней активности (от Mg до H) реагируют с водой при нагревании (с водяным паром). Металлы после H не реагируют.
Na: Натрий бурно реагирует с водой с образованием щелочи и выделением водорода.
Уравнение: $2Na + 2H_2O \rightarrow 2NaOH + H_2 \uparrow$
Условия: Обычные условия (реакция протекает со взрывом).
Ca: Кальций активно реагирует с водой, но менее бурно, чем натрий.
Уравнение: $Ca + 2H_2O \rightarrow Ca(OH)_2 + H_2 \uparrow$
Условия: Обычные условия.
Zn: Цинк реагирует только с водяным паром при высокой температуре.
Уравнение: $Zn + H_2O \xrightarrow{t} ZnO + H_2 \uparrow$
Условия: Высокая температура (раскаленный цинк).
Cu: Медь стоит в ряду активности после водорода и не реагирует с водой.
Реакция практически не осуществима.
Ag: Серебро стоит в ряду активности после водорода и не реагирует с водой.
Реакция практически не осуществима.
Ответ: Na, Ca реагируют с водой при обычных условиях, Zn - при нагревании. Cu и Ag не реагируют.
Pb(NO₃)₂ (в растворе)
Более активные металлы вытесняют менее активные из растворов их солей. Однако очень активные металлы (Na, Ca) в первую очередь будут реагировать с водой, а не с солью.
Na: Натрий слишком активен и будет реагировать с водой в растворе. Прямого вытеснения свинца не произойдет.
Первичная реакция: $2Na + 2H_2O \rightarrow 2NaOH + H_2 \uparrow$. Затем гидроксид натрия может прореагировать с нитратом свинца: $2NaOH + Pb(NO_3)_2 \rightarrow Pb(OH)_2 \downarrow + 2NaNO_3$.
Реакция вытеснения практически не осуществима.
Ca: Аналогично натрию, кальций будет реагировать с водой.
Первичная реакция: $Ca + 2H_2O \rightarrow Ca(OH)_2 + H_2 \uparrow$. Затем: $Ca(OH)_2 + Pb(NO_3)_2 \rightarrow Pb(OH)_2 \downarrow + Ca(NO_3)_2$.
Реакция вытеснения практически не осуществима.
Zn: Цинк активнее свинца и вытесняет его из раствора соли.
Уравнение: $Zn + Pb(NO_3)_2 \rightarrow Zn(NO_3)_2 + Pb \downarrow$
Условия: Обычные условия.
Cu: Медь менее активна, чем свинец.
Реакция практически не осуществима.
Ag: Серебро менее активно, чем свинец.
Реакция практически не осуществима.
Ответ: Только Zn вытесняет свинец из раствора его соли. Na и Ca реагируют с водой. Cu и Ag не реагируют, так как менее активны.
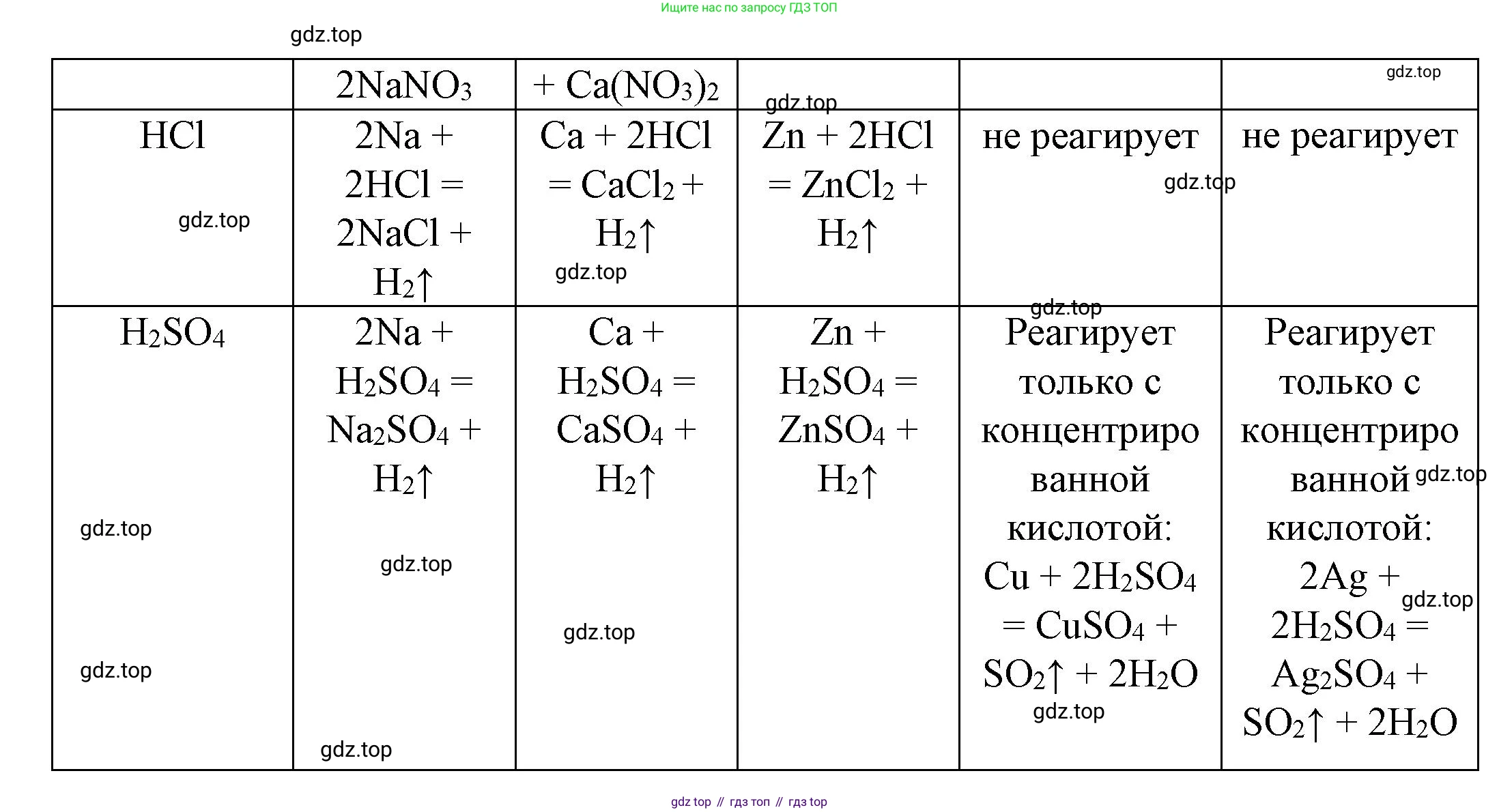
HCl
Металлы, стоящие в ряду активности до водорода, вытесняют его из растворов кислот (кроме азотной и концентрированной серной). Металлы после водорода не реагируют.
Na: Натрий бурно реагирует с соляной кислотой.
Уравнение: $2Na + 2HCl \rightarrow 2NaCl + H_2 \uparrow$
Условия: Обычные условия.
Ca: Кальций активно реагирует с соляной кислотой.
Уравнение: $Ca + 2HCl \rightarrow CaCl_2 + H_2 \uparrow$
Условия: Обычные условия.
Zn: Цинк реагирует с соляной кислотой.
Уравнение: $Zn + 2HCl \rightarrow ZnCl_2 + H_2 \uparrow$
Условия: Обычные условия.
Cu: Медь стоит после водорода.
Реакция практически не осуществима.
Ag: Серебро стоит после водорода.
Реакция практически не осуществима.
Ответ: Na, Ca, Zn реагируют с HCl. Cu и Ag не реагируют.
H₂SO₄
Свойства серной кислоты сильно зависят от ее концентрации. Предполагается, что имеется в виду разбавленная серная кислота, которая ведет себя как обычная кислота.
Na: Натрий бурно реагирует с разбавленной серной кислотой.
Уравнение: $2Na + H_2SO_4 \rightarrow Na_2SO_4 + H_2 \uparrow$
Условия: Обычные условия.
Ca: Кальций реагирует с разбавленной серной кислотой, но реакция быстро замедляется, так как образующийся сульфат кальция $CaSO_4$ малорастворим и покрывает поверхность металла.
Уравнение: $Ca + H_2SO_4 \rightarrow CaSO_4 \downarrow + H_2 \uparrow$
Условия: Обычные условия.
Zn: Цинк реагирует с разбавленной серной кислотой.
Уравнение: $Zn + H_2SO_4 \rightarrow ZnSO_4 + H_2 \uparrow$
Условия: Обычные условия.
Cu: Медь стоит после водорода и с разбавленной серной кислотой не реагирует.
Реакция практически не осуществима. (Однако медь реагирует с концентрированной $H_2SO_4$ при нагревании: $Cu + 2H_2SO_{4(конц.)} \xrightarrow{t} CuSO_4 + SO_2 \uparrow + 2H_2O$).
Ag: Серебро стоит после водорода и с разбавленной серной кислотой не реагирует.
Реакция практически не осуществима. (Однако серебро реагирует с концентрированной $H_2SO_4$ при нагревании: $2Ag + 2H_2SO_{4(конц.)} \xrightarrow{t} Ag_2SO_4 + SO_2 \uparrow + 2H_2O$).
Ответ: С разбавленной $H_2SO_4$ реагируют Na, Ca, Zn. Не реагируют Cu и Ag.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 2 расположенного на странице 148 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 148), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















