Номер 3, страница 143 - гдз по химии 9 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2023
Цвет обложки: зелёный
ISBN: 978-5-09-113569-5
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава 7. Металлы. Параграф 40. Нахождение металлов в природе и общие способы их получения. Подумай, ответь, выполни... - номер 3, страница 143.
№3 (с. 143)
Условие. №3 (с. 143)
скриншот условия

3. Восстановите левую часть схемы реакции:
$... + ... \rightarrow \text{Pb} + \text{CO}_2$
Решение. №3 (с. 143)
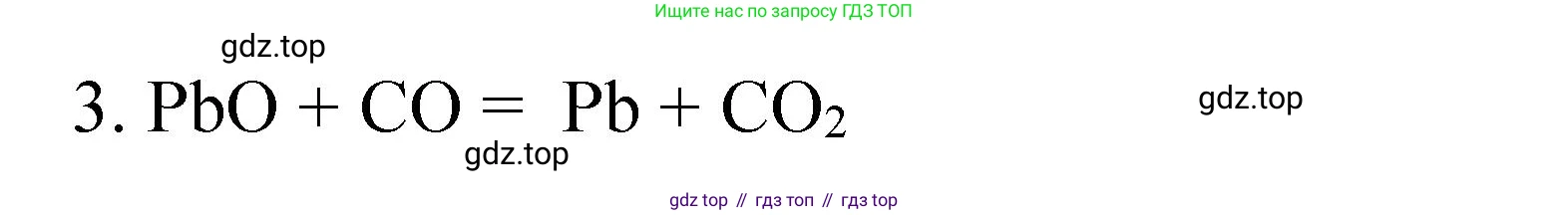
Решение 2. №3 (с. 143)
Чтобы восстановить левую часть схемы реакции, необходимо определить, какие вещества (реагенты) при взаимодействии образуют указанные продукты: металлический свинец ($Pb$) и диоксид углерода ($CO_2$).
Решение
1. Проанализируем продукты реакции. В правой части уравнения находятся простое вещество свинец ($Pb$) и оксид углерода(IV) ($CO_2$).
2. Данная реакция является окислительно-восстановительной. Определим степени окисления элементов в продуктах:
Свинец $Pb^0$ (степень окисления простого вещества равна нулю).
Диоксид углерода $C^{+4}O_2^{-2}$ (углерод имеет степень окисления +4, а кислород -2).
3. Поскольку свинец в продуктах имеет степень окисления 0, в исходном веществе он должен был иметь положительную степень окисления. Это означает, что соединение свинца выступало в роли окислителя, а ион свинца в ходе реакции восстановился (принял электроны). Наиболее вероятным исходным веществом является оксид свинца(II) - $PbO$, где свинец имеет степень окисления +2.
Процесс восстановления: $Pb^{+2} + 2e^- \rightarrow Pb^0$
4. Углерод в продуктах ($CO_2$) имеет степень окисления +4. Значит, в исходном веществе он должен был иметь более низкую степень окисления. Вещество, содержащее углерод, было восстановителем, а сам углерод окислился (отдал электроны). В качестве восстановителя, который при окислении дает $CO_2$, может выступать либо чистый углерод ($C^0$), либо оксид углерода(II), или угарный газ ($C^{+2}O$).
Рассмотрим вариант с угарным газом ($CO$):
Процесс окисления: $C^{+2} - 2e^- \rightarrow C^{+4}$
5. Составим уравнение реакции, используя в качестве реагентов оксид свинца(II) и оксид углерода(II):
$PbO + CO \rightarrow Pb + CO_2$
6. Проверим баланс атомов в уравнении. Подсчитаем количество атомов каждого элемента в левой и правой частях:
- Свинец (Pb): слева 1, справа 1 (уравнено).
- Углерод (C): слева 1, справа 1 (уравнено).
- Кислород (O): слева 1 (в PbO) + 1 (в CO) = 2; справа 2 (в $CO_2$) (уравнено).
Уравнение полностью сбалансировано, и все стехиометрические коэффициенты равны 1. Эта реакция является классическим примером карботермии — восстановления металла из его оксида.
Примечание: Существуют и другие правильные варианты решения, например, восстановление оксида свинца(II) углем: $2PbO + C \rightarrow 2Pb + CO_2$. Представленный выше вариант с $CO$ является одним из наиболее распространенных и стехиометрически простых.
Ответ: $PbO + CO \rightarrow Pb + CO_2$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 3 расположенного на странице 143 к учебнику 2019 - 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №3 (с. 143), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) учебного пособия издательства Просвещение.















