Номер 20, страница 240 - гдз по химии 10-11 класс задачник Еремин, Дроздов

Авторы: Еремин В. В., Дроздов А. А., Ромашов Л. В.
Тип: Задачник
Издательство: Просвещение
Год издания: 2023 - 2025
Цвет обложки: белый, зелёный
ISBN: 978-5-09-109700-9
Популярные ГДЗ в 10 классе
Тема 9. Переходные металлы. Комплексные соединения. 9.1. Хром и марганец. Уровень 1 - номер 20, страница 240.
№20 (с. 240)
Условие. №20 (с. 240)
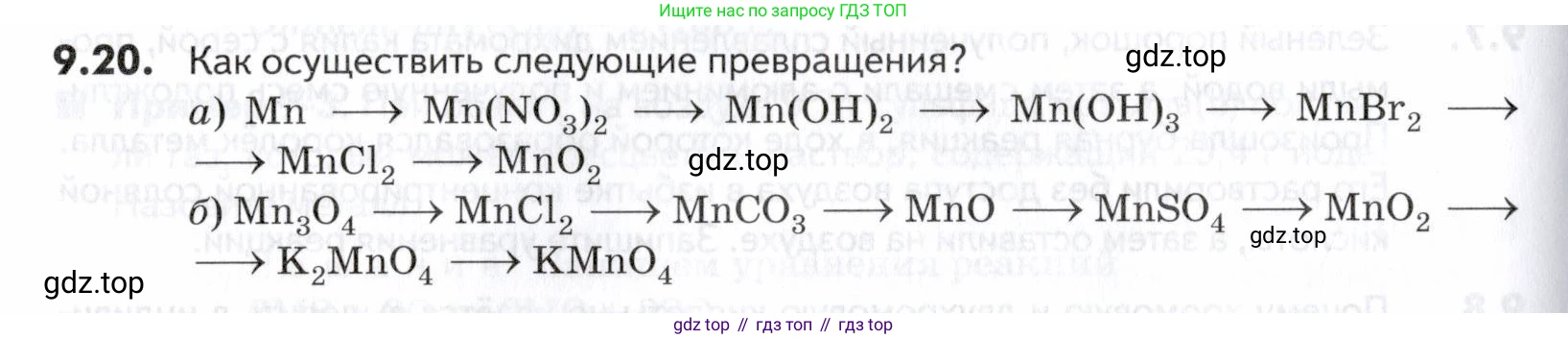
9.20. Как осуществить следующие превращения?
Решение 3. №20 (с. 240)
Для осуществления данных цепочек превращений можно провести следующие химические реакции:
а) $Mn \rightarrow Mn(NO_3)_2 \rightarrow Mn(OH)_2 \rightarrow Mn(OH)_3 \rightarrow MnBr_2 \rightarrow MnCl_2 \rightarrow MnO_2$1. Металлический марганец растворяют в разбавленной азотной кислоте. В ходе реакции образуется нитрат марганца(II):
$3Mn + 8HNO_3(\text{разб.}) \rightarrow 3Mn(NO_3)_2 + 2NO \uparrow + 4H_2O$
2. Для получения гидроксида марганца(II), нерастворимого в воде основания, к раствору нитрата марганца(II) добавляют раствор щелочи, например, гидроксида натрия:
$Mn(NO_3)_2 + 2NaOH \rightarrow Mn(OH)_2 \downarrow + 2NaNO_3$
3. Гидроксид марганца(II) легко окисляется до гидроксида марганца(III). В качестве окислителя можно использовать пероксид водорода:
$2Mn(OH)_2 + H_2O_2 \rightarrow 2Mn(OH)_3 \downarrow$
4. Гидроксид марганца(III) проявляет окислительные свойства и реагирует с концентрированной бромоводородной кислотой. При этом марганец восстанавливается до степени окисления +2, а бром окисляется:
$2Mn(OH)_3 + 6HBr \rightarrow 2MnBr_2 + Br_2 + 6H_2O$
5. Более активный галоген, хлор, вытесняет бром из его соли. При пропускании хлора через раствор бромида марганца образуется хлорид марганца(II):
$MnBr_2 + Cl_2 \rightarrow MnCl_2 + Br_2$
6. Окисление хлорида марганца(II) до диоксида марганца можно провести в щелочной среде с помощью сильного окислителя, например, хлора:
$MnCl_2 + Cl_2 + 4NaOH \rightarrow MnO_2 \downarrow + 4NaCl + 2H_2O$
Ответ:
1. $3Mn + 8HNO_3(\text{разб.}) \rightarrow 3Mn(NO_3)_2 + 2NO \uparrow + 4H_2O$
2. $Mn(NO_3)_2 + 2NaOH \rightarrow Mn(OH)_2 \downarrow + 2NaNO_3$
3. $2Mn(OH)_2 + H_2O_2 \rightarrow 2Mn(OH)_3 \downarrow$
4. $2Mn(OH)_3 + 6HBr \rightarrow 2MnBr_2 + Br_2 + 6H_2O$
5. $MnBr_2 + Cl_2 \rightarrow MnCl_2 + Br_2$
6. $MnCl_2 + Cl_2 + 4NaOH \rightarrow MnO_2 \downarrow + 4NaCl + 2H_2O$
б) $Mn_3O_4 \rightarrow MnCl_2 \rightarrow MnCO_3 \rightarrow MnO \rightarrow MnSO_4 \rightarrow MnO_2 \rightarrow K_2MnO_4 \rightarrow KMnO_4$1. Оксид марганца(II, IV) $Mn_3O_4$ (минерал гаусманит) реагирует с концентрированной соляной кислотой. Марганец(IV) в составе оксида окисляет хлорид-ионы до свободного хлора, а сам восстанавливается до марганца(II):
$Mn_3O_4 + 8HCl(\text{конц.}) \xrightarrow{t} 3MnCl_2 + Cl_2 \uparrow + 4H_2O$
2. Карбонат марганца(II) получают реакцией обмена между раствором хлорида марганца(II) и раствором растворимого карбоната, например, карбоната натрия:
$MnCl_2 + Na_2CO_3 \rightarrow MnCO_3 \downarrow + 2NaCl$
3. Оксид марганца(II) можно получить термическим разложением карбоната марганца(II) при нагревании в инертной атмосфере (чтобы избежать окисления):
$MnCO_3 \xrightarrow{t, \text{без доступа } O_2} MnO + CO_2 \uparrow$
4. Оксид марганца(II) является основным оксидом и реагирует с кислотами, например, с серной кислотой, с образованием соли и воды:
$MnO + H_2SO_4 \rightarrow MnSO_4 + H_2O$
5. Для окисления сульфата марганца(II) до диоксида марганца можно использовать сильный окислитель, перманганат калия, в нейтральной среде. Эта реакция является сопропорционированием:
$3MnSO_4 + 2KMnO_4 + 2H_2O \rightarrow 5MnO_2 \downarrow + K_2SO_4 + 2H_2SO_4$
6. Манганат калия зеленого цвета получают сплавлением диоксида марганца со щелочью (гидроксидом калия) в присутствии окислителя (например, кислорода воздуха) при высокой температуре:
$2MnO_2 + 4KOH + O_2 \xrightarrow{t} 2K_2MnO_4 + 2H_2O$
7. Перманганат калия можно получить из манганата калия окислением с помощью более сильного окислителя, чем кислород, например, хлора:
$2K_2MnO_4 + Cl_2 \rightarrow 2KMnO_4 + 2KCl$
Ответ:
1. $Mn_3O_4 + 8HCl(\text{конц.}) \xrightarrow{t} 3MnCl_2 + Cl_2 \uparrow + 4H_2O$
2. $MnCl_2 + Na_2CO_3 \rightarrow MnCO_3 \downarrow + 2NaCl$
3. $MnCO_3 \xrightarrow{t, \text{без доступа } O_2} MnO + CO_2 \uparrow$
4. $MnO + H_2SO_4 \rightarrow MnSO_4 + H_2O$
5. $3MnSO_4 + 2KMnO_4 + 2H_2O \rightarrow 5MnO_2 \downarrow + K_2SO_4 + 2H_2SO_4$
6. $2MnO_2 + 4KOH + O_2 \xrightarrow{t} 2K_2MnO_4 + 2H_2O$
7. $2K_2MnO_4 + Cl_2 \rightarrow 2KMnO_4 + 2KCl$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Мы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10-11 класс, для упражнения номер 20 расположенного на странице 240 к задачнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №20 (с. 240), авторов: Еремин (Вадим Владимирович), Дроздов (Андрей Анатольевич), Ромашов (Леонид Владимирович), ФГОС (новый, красный) учебного пособия издательства Просвещение.




















