Номер 2, страница 21 - гдз по химии 10 класс учебник Рудзитис, Фельдман

Авторы: Рудзитис Г. Е., Фельдман Ф. Г.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2025
Уровень обучения: базовый
Цвет обложки: коричневый
ISBN: 978-5-09-088084-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 10 классе
Глава I. Теория химического строения органических соединений. Природа химических связей. Параграф 5. Электронная природа химических связей в органических соединениях - номер 2, страница 21.
№2 (с. 21)
Условие. №2 (с. 21)
скриншот условия
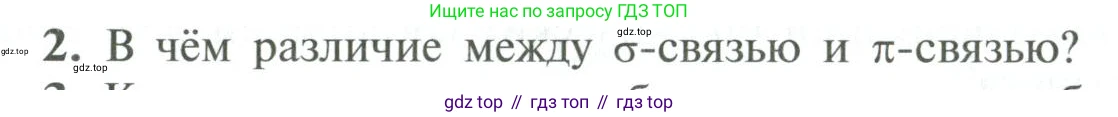
2. В чём различие между $\sigma$-связью и $\pi$-связью?
Решение. №2 (с. 21)

Решение 2. №2 (с. 21)
Решение
$ \sigma $-связь и $ \pi $-связь — это два основных типа ковалентных связей, которые образуются в результате перекрывания атомных орбиталей. Их главное различие заключается в способе перекрывания этих орбиталей и, как следствие, в геометрии и свойствах образующейся связи.
$ \sigma $-связь (сигма-связь)
Сигма-связь образуется при "лобовом" перекрывании атомных орбиталей вдоль линии, соединяющей ядра связываемых атомов (межъядерной оси). Электронная плотность при этом концентрируется непосредственно между ядрами.
Она может формироваться в результате перекрывания:
1. Двух $s$-орбиталей (например, в молекуле $H_2$).
2. Одной $s$- и одной $p$-орбитали (например, в молекуле $HCl$).
3. Двух $p$-орбиталей, ориентированных вдоль оси связи (например, в молекуле $F_2$).
Ключевые характеристики $ \sigma $-связи:
- Это самый прочный тип ковалентной связи, так как перекрывание орбиталей максимально.
- Она обладает осевой симметрией, что означает возможность свободного вращения атомов вокруг оси связи без её разрыва.
- Любая одинарная связь всегда является $ \sigma $-связью. В двойных и тройных связях также всегда присутствует одна $ \sigma $-связь.
Ответ: $ \sigma $-связь — это прочная ковалентная связь, образованная осевым ("лобовым") перекрыванием атомных орбиталей с концентрацией электронной плотности на линии, соединяющей ядра.
$ \pi $-связь (пи-связь)
Пи-связь образуется при "боковом" перекрывании негибридных $p$-орбиталей (или $d$-орбиталей), оси которых параллельны друг другу и перпендикулярны линии, соединяющей ядра.
В результате такого перекрывания образуются две области повышенной электронной плотности, расположенные по обе стороны от межъядерной оси (над и под плоскостью $ \sigma $-связи).
Ключевые характеристики $ \pi $-связи:
- Она слабее, чем $ \sigma $-связь, поскольку боковое перекрывание орбиталей менее эффективно, чем лобовое.
- Она не существует самостоятельно, а образуется только в дополнение к $ \sigma $-связи, формируя кратные связи: двойная связь состоит из одной $ \sigma $- и одной $ \pi $-связи, а тройная — из одной $ \sigma $- и двух $ \pi $-связей.
- Наличие $ \pi $-связи делает невозможным свободное вращение атомов вокруг оси связи, так как это привело бы к разрыву $ \pi $-связи. Это является причиной существования цис-транс-изомерии у алкенов.
Ответ: $ \pi $-связь — это менее прочная ковалентная связь, образованная боковым перекрыванием $p$-орбиталей, с электронной плотностью, расположенной над и под плоскостью $ \sigma $-связи.
Основные различия обобщённо:
1. Способ образования: $ \sigma $-связь — лобовое перекрывание, $ \pi $-связь — боковое.
2. Участвующие орбитали: $ \sigma $-связь может быть образована $s$-, $p$- и гибридными орбиталями. $ \pi $-связь образуется, как правило, негибридными $p$-орбиталями.
3. Расположение электронной плотности: у $ \sigma $-связи — на межъядерной оси; у $ \pi $-связи — над и под межъядерной осью.
4. Прочность: $ \sigma $-связь значительно прочнее $ \pi $-связи.
5. Вращение вокруг связи: вокруг одинарной $ \sigma $-связи вращение свободное; наличие $ \pi $-связи блокирует свободное вращение.
6. Наличие в молекулах: $ \sigma $-связь есть в любой ковалентной связи. $ \pi $-связь присутствует только в кратных (двойных и тройных) связях.
Ответ: Главные различия между $ \sigma $- и $ \pi $-связями заключаются в способе перекрывания орбиталей (осевое против бокового), что определяет их прочность ( $ \sigma $ > $ \pi $ ), геометрию расположения электронной плотности и возможность свободного вращения атомов вокруг связи.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 10 класс, для упражнения номер 2 расположенного на странице 21 к учебнику 2019 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2 (с. 21), авторов: Рудзитис (Гунтис Екабович), Фельдман (Фриц Генрихович), ФГОС (старый) базовый уровень обучения учебного пособия издательства Просвещение.




















