Номер 2.34, страница 49, часть II - гдз по химии 8-9 класс задачник с помощником Гара, Габрусева
Авторы: Гара Н. Н., Габрусева Н. И.
Тип: Задачник с помощником
Издательство: Просвещение
Год издания: 2009 - 2026
Часть: II
Цвет обложки: зелёный, синий
ISBN: 978-5-09-037902-1
Популярные ГДЗ в 8 классе
Часть II. Вычисления по химическим уравнениям. 2. Вычисление массы (количества вещества, объема) продукта реакции, если известна масса исходного вещества, содержащего определенную долю примесей - номер 2.34, страница 49.
№2.34 (с. 49)
Условие. №2.34 (с. 49)
скриншот условия

2.34. Вычислите массу уксусно-этилового эфира, полученного при взаимодействии уксусной кислоты со 100 г этилового спирта, содержащего 8% примесей.
Решение. №2.34 (с. 49)

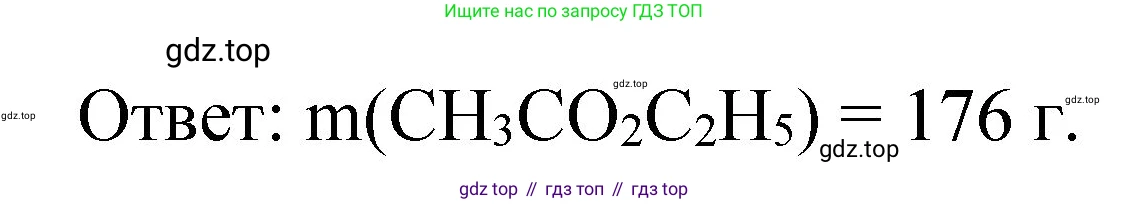
Решение 2. №2.34 (с. 49)
Дано:
$m(\text{раствора } C_2H_5OH) = 100 \text{ г}$
$\omega(\text{примесей}) = 8\%$
$m(\text{раствора } C_2H_5OH) = 0.1 \text{ кг}$
$\omega(\text{примесей}) = 0.08$
Найти:
$m(CH_3COOC_2H_5)$ — ?
Решение:1. Запишем уравнение реакции этерификации — взаимодействия уксусной кислоты с этиловым спиртом с образованием сложного эфира (уксусно-этилового эфира или этилацетата) и воды. По условию задачи, уксусная кислота находится в избытке, поэтому расчет ведем по этиловому спирту.
$CH_3COOH + C_2H_5OH \xrightarrow{H^+} CH_3COOC_2H_5 + H_2O$
2. Определим массовую долю чистого этилового спирта в исходном растворе. Если массовая доля примесей составляет 8%, то массовая доля спирта:
$\omega(C_2H_5OH) = 100\% - \omega(\text{примесей}) = 100\% - 8\% = 92\%$ или $0.92$.
3. Найдем массу чистого этилового спирта, который вступит в реакцию. Для удобства расчетов будем использовать массу в граммах.
$m(C_2H_5OH) = m(\text{раствора}) \cdot \omega(C_2H_5OH) = 100 \text{ г} \cdot 0.92 = 92 \text{ г}$.
4. Рассчитаем молярные массы этилового спирта ($C_2H_5OH$) и уксусно-этилового эфира ($CH_3COOC_2H_5$), используя относительные атомные массы элементов: $A_r(C)=12$, $A_r(H)=1$, $A_r(O)=16$.
Молярная масса этилового спирта:
$M(C_2H_5OH) = 2 \cdot 12 + 6 \cdot 1 + 16 = 46 \text{ г/моль}$.
Молярная масса уксусно-этилового эфира:
$M(CH_3COOC_2H_5) = 4 \cdot 12 + 8 \cdot 1 + 2 \cdot 16 = 88 \text{ г/моль}$.
5. Найдем количество вещества (число молей) чистого этилового спирта.
$n(C_2H_5OH) = \frac{m(C_2H_5OH)}{M(C_2H_5OH)} = \frac{92 \text{ г}}{46 \text{ г/моль}} = 2 \text{ моль}$.
6. Согласно уравнению реакции, из 1 моль этилового спирта образуется 1 моль уксусно-этилового эфира. Следовательно, их количества вещества соотносятся как 1:1.
$n(CH_3COOC_2H_5) = n(C_2H_5OH) = 2 \text{ моль}$.
7. Рассчитаем массу уксусно-этилового эфира, который образуется в результате реакции.
$m(CH_3COOC_2H_5) = n(CH_3COOC_2H_5) \cdot M(CH_3COOC_2H_5) = 2 \text{ моль} \cdot 88 \text{ г/моль} = 176 \text{ г}$.
Ответ:масса полученного уксусно-этилового эфира составляет 176 г.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8-9 класс, для упражнения номер 2.34 расположенного на странице 49 для II-й части к задачнику с помощником 2009 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №2.34 (с. 49), авторов: Гара (Наталья Николаевна), Габрусева (Надежда Ивановна), II-й части учебного пособия издательства Просвещение.
















