Номер 4, страница 122 - гдз по химии 8 класс учебник Рудзитис

Авторы: Рудзитис Г. Е.
Тип: Учебник
Издательство: Просвещение
Год издания: 2019 - 2022
ISBN: 978-5-09-088251-4
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 8 классе
Глава 5. Количественные отношения в химии. Параграф 36. Количество вещества. Моль. Молярная масса. Подумай, ответь, выполни... - номер 4, страница 122.
№4 (с. 122)
Условие. №4 (с. 122)
скриншот условия

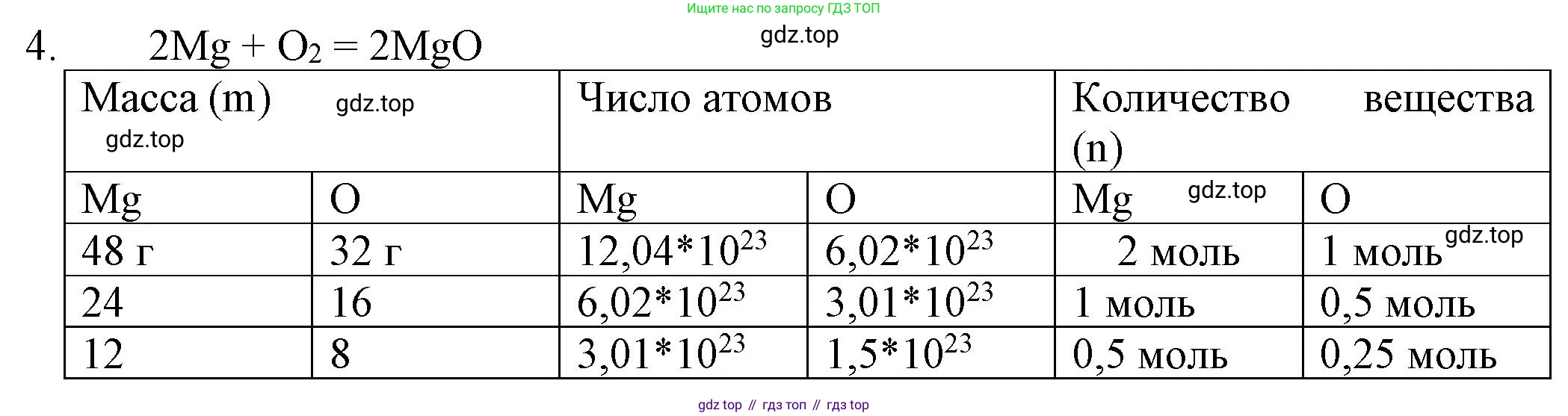
4. Дано уравнение реакции $2Mg + O_2 = 2MgO$. Согласно этому уравнению по аналогии с таблицей 6 составьте таблицу, показывающую соотношения между массой реагирующих веществ в граммах, числом атомов и количеством вещества.
Решение. №4 (с. 122)
Решение 2. №4 (с. 122)
Дано:
Уравнение реакции: $2\text{Mg} + \text{O}_2 = 2\text{MgO}$
Относительные атомные массы: $A_r(\text{Mg}) = 24$; $A_r(\text{O}) = 16$.
Постоянная Авогадро: $N_A \approx 6.02 \cdot 10^{23} \text{ моль}^{-1}$.
Найти:
Составить таблицу, показывающую соотношения между массой реагирующих веществ в граммах, числом частиц (атомов/молекул) и количеством вещества.
Решение:
Для составления таблицы проведем необходимые расчеты, основываясь на стехиометрических коэффициентах в уравнении реакции.
1. Определение количества вещества ($\text{n}$).
Коэффициенты в уравнении реакции (2 для Mg, 1 для O₂, 2 для MgO) показывают молярное соотношение реагентов и продуктов:
$n(\text{Mg}) : n(\text{O}_2) : n(\text{MgO}) = 2 : 1 : 2$.
Для расчетов примем количество вещества, равное его стехиометрическому коэффициенту, в молях:
$n(\text{Mg})=2$ моль
$n(\text{O}_2)=1$ моль
$n(\text{MgO})=2$ моль
2. Расчет масс ($\text{m}$).
Массу каждого вещества найдем по формуле $m = n \cdot M$, где $\text{M}$ – молярная масса. Сначала определим молярные массы:
$M(\text{Mg}) = 24$ г/моль
$M(\text{O}_2) = 2 \cdot 16 = 32$ г/моль
$M(\text{MgO}) = 24 + 16 = 40$ г/моль
Теперь рассчитаем массы веществ, участвующих в реакции:
$m(\text{Mg}) = 2 \text{ моль} \cdot 24 \text{ г/моль} = 48$ г
$m(\text{O}_2) = 1 \text{ моль} \cdot 32 \text{ г/моль} = 32$ г
$m(\text{MgO}) = 2 \text{ моль} \cdot 40 \text{ г/моль} = 80$ г
Согласно закону сохранения массы, масса реагентов равна массе продуктов: $48 \text{ г} + 32 \text{ г} = 80 \text{ г}$.
3. Расчет числа частиц ($\text{N}$).
Число частиц (атомов для Mg, молекул для O₂, формульных единиц для MgO) найдем по формуле $N = n \cdot N_A$.
Число атомов магния:
$N(\text{Mg}) = 2 \text{ моль} \cdot 6.02 \cdot 10^{23} \text{ моль}^{-1} = 12.04 \cdot 10^{23}$ атомов
Число молекул кислорода:
$N(\text{O}_2) = 1 \text{ моль} \cdot 6.02 \cdot 10^{23} \text{ моль}^{-1} = 6.02 \cdot 10^{23}$ молекул
Число формульных единиц оксида магния:
$N(\text{MgO}) = 2 \text{ моль} \cdot 6.02 \cdot 10^{23} \text{ моль}^{-1} = 12.04 \cdot 10^{23}$ формульных единиц
Ответ:
На основе выполненных расчетов составим итоговую таблицу соотношений для реакции $2\text{Mg} + \text{O}_2 = 2\text{MgO}$.
| Характеристика | $2\text{Mg}$ | $\text{O}_2$ | $2\text{MgO}$ |
|---|---|---|---|
| Количество вещества, моль | 2 | 1 | 2 |
| Масса, г | 48 | 32 | 80 |
| Число частиц | $12.04 \cdot 10^{23}$ атомов | $6.02 \cdot 10^{23}$ молекул | $12.04 \cdot 10^{23}$ ф. е. |
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 8 класс, для упражнения номер 4 расположенного на странице 122 к учебнику 2019 - 2022 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №4 (с. 122), автора: Рудзитис (Гунтис Екабович), ФГОС (старый) учебного пособия издательства Просвещение.















