Номер 5, страница 48 - гдз по химии 9 класс учебник Габриелян, Остроумов

Авторы: Габриелян О. С., Остроумов И. Г., Сладков С. А.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-110655-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава II. Химические реакции в растворах. §8. Химические свойства солей как электролитов. Примените свои знания - номер 5, страница 48.
№5 (с. 48)
Условие. №5 (с. 48)
скриншот условия

5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
a) $P \rightarrow P_2O_5 \rightarrow H_3PO_4 \rightarrow Ca_3(PO_4)_2$
б) $Zn \rightarrow ZnCl_2 \rightarrow Zn(OH)_2 \rightarrow ZnO \rightarrow ZnSO_4 \rightarrow Zn(NO_3)_2$
в) $Na_2O \rightarrow NaOH \rightarrow NaHCO_3 \rightarrow Na_2CO_3 \rightarrow Na_2SO_4$
Реакции с участием электролитов запишите также и в ионном виде.
Решение. №5 (с. 48)
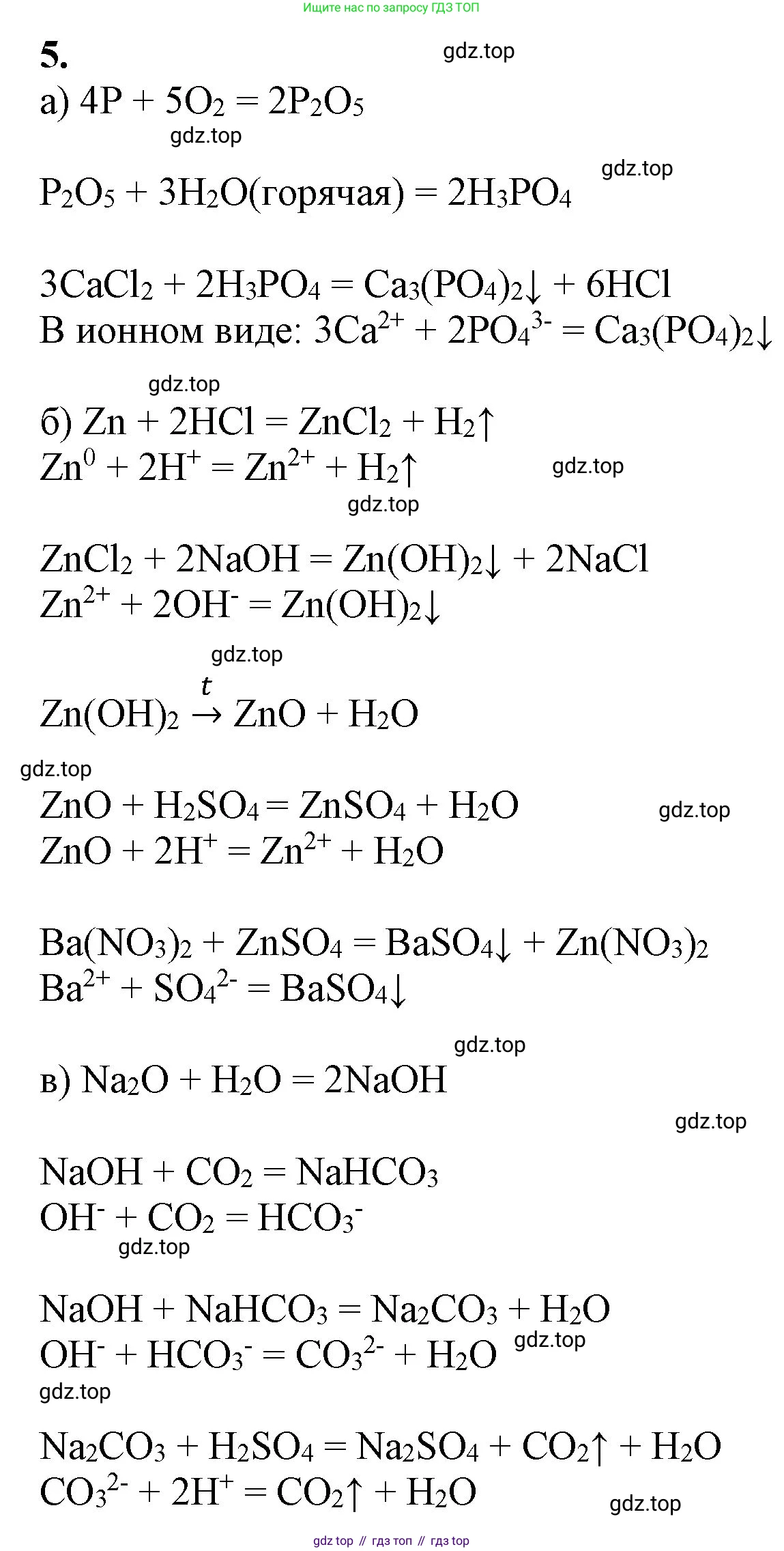
Решение 2. №5 (с. 48)
а) $P \rightarrow P_2O_5 \rightarrow H_3PO_4 \rightarrow Ca_3(PO_4)_2$
Решение:
1. Сжигание фосфора в избытке кислорода приводит к образованию оксида фосфора(V):
$4P + 5O_2 \xrightarrow{t} 2P_2O_5$
2. Оксид фосфора(V) является кислотным оксидом и реагирует с водой, образуя ортофосфорную кислоту:
$P_2O_5 + 3H_2O \rightarrow 2H_3PO_4$
3. Для получения фосфата кальция можно использовать реакцию нейтрализации ортофосфорной кислоты гидроксидом кальция. Фосфат кальция выпадает в осадок.
$2H_3PO_4 + 3Ca(OH)_2 \rightarrow Ca_3(PO_4)_2 \downarrow + 6H_2O$
Это реакция с участием электролитов ($H_3PO_4$ - кислота, $Ca(OH)_2$ - основание).
Полное ионное уравнение (учитывая, что $H_3PO_4$ - слабая кислота, а $Ca(OH)_2$ - сильное основание):
$2H_3PO_4 + 3Ca^{2+} + 6OH^- \rightarrow Ca_3(PO_4)_2 \downarrow + 6H_2O$
Сокращенное ионное уравнение в данном случае совпадает с полным, так как все ионы участвуют в образовании осадка и воды.
Ответ:
$4P + 5O_2 \xrightarrow{t} 2P_2O_5$
$P_2O_5 + 3H_2O \rightarrow 2H_3PO_4$
$2H_3PO_4 + 3Ca(OH)_2 \rightarrow Ca_3(PO_4)_2 \downarrow + 6H_2O$
б) $Zn \rightarrow ZnCl_2 \rightarrow Zn(OH)_2 \rightarrow ZnO \rightarrow ZnSO_4 \rightarrow Zn(NO_3)_2$
Решение:
1. Цинк реагирует с соляной кислотой с образованием хлорида цинка и выделением водорода:
$Zn + 2HCl \rightarrow ZnCl_2 + H_2 \uparrow$
Полное ионное уравнение: $Zn + 2H^+ + 2Cl^- \rightarrow Zn^{2+} + 2Cl^- + H_2 \uparrow$
Сокращенное ионное уравнение: $Zn + 2H^+ \rightarrow Zn^{2+} + H_2 \uparrow$
2. При добавлении щелочи (например, гидроксида натрия) к раствору хлорида цинка выпадает осадок гидроксида цинка:
$ZnCl_2 + 2NaOH \rightarrow Zn(OH)_2 \downarrow + 2NaCl$
Полное ионное уравнение: $Zn^{2+} + 2Cl^- + 2Na^+ + 2OH^- \rightarrow Zn(OH)_2 \downarrow + 2Na^+ + 2Cl^-$
Сокращенное ионное уравнение: $Zn^{2+} + 2OH^- \rightarrow Zn(OH)_2 \downarrow$
3. Нерастворимые гидроксиды, как гидроксид цинка, при нагревании разлагаются на оксид и воду:
$Zn(OH)_2 \xrightarrow{t} ZnO + H_2O$
4. Оксид цинка, будучи амфотерным оксидом с преобладанием основных свойств, реагирует с кислотами, например, с серной кислотой, образуя соль и воду:
$ZnO + H_2SO_4 \rightarrow ZnSO_4 + H_2O$
Полное ионное уравнение: $ZnO + 2H^+ + SO_4^{2-} \rightarrow Zn^{2+} + SO_4^{2-} + H_2O$
Сокращенное ионное уравнение: $ZnO + 2H^+ \rightarrow Zn^{2+} + H_2O$
5. Чтобы получить нитрат цинка из сульфата цинка, можно использовать реакцию с нитратом бария. В результате реакции обмена образуется нерастворимый сульфат бария:
$ZnSO_4 + Ba(NO_3)_2 \rightarrow Zn(NO_3)_2 + BaSO_4 \downarrow$
Полное ионное уравнение: $Zn^{2+} + SO_4^{2-} + Ba^{2+} + 2NO_3^- \rightarrow Zn^{2+} + 2NO_3^- + BaSO_4 \downarrow$
Сокращенное ионное уравнение: $Ba^{2+} + SO_4^{2-} \rightarrow BaSO_4 \downarrow$
Ответ:
$Zn + 2HCl \rightarrow ZnCl_2 + H_2 \uparrow$
$ZnCl_2 + 2NaOH \rightarrow Zn(OH)_2 \downarrow + 2NaCl$
$Zn(OH)_2 \xrightarrow{t} ZnO + H_2O$
$ZnO + H_2SO_4 \rightarrow ZnSO_4 + H_2O$
$ZnSO_4 + Ba(NO_3)_2 \rightarrow Zn(NO_3)_2 + BaSO_4 \downarrow$
в) $Na_2O \rightarrow NaOH \rightarrow NaHCO_3 \rightarrow Na_2CO_3 \rightarrow Na_2SO_4$
Решение:
1. Оксид натрия — основный оксид, который активно реагирует с водой с образованием гидроксида натрия (щелочи):
$Na_2O + H_2O \rightarrow 2NaOH$
2. При пропускании избытка углекислого газа через раствор гидроксида натрия образуется кислая соль — гидрокарбонат натрия:
$NaOH + CO_2 \rightarrow NaHCO_3$
Полное ионное уравнение: $Na^+ + OH^- + CO_2 \rightarrow Na^+ + HCO_3^-$
Сокращенное ионное уравнение: $OH^- + CO_2 \rightarrow HCO_3^-$
3. Гидрокарбонат натрия можно превратить в карбонат натрия, добавив к нему щелочь:
$NaHCO_3 + NaOH \rightarrow Na_2CO_3 + H_2O$
Полное ионное уравнение: $Na^+ + HCO_3^- + Na^+ + OH^- \rightarrow 2Na^+ + CO_3^{2-} + H_2O$
Сокращенное ионное уравнение: $HCO_3^- + OH^- \rightarrow CO_3^{2-} + H_2O$
4. Для получения сульфата натрия из карбоната натрия, нужно подействовать на карбонат серной кислотой. В результате реакции выделится углекислый газ:
$Na_2CO_3 + H_2SO_4 \rightarrow Na_2SO_4 + H_2O + CO_2 \uparrow$
Полное ионное уравнение: $2Na^+ + CO_3^{2-} + 2H^+ + SO_4^{2-} \rightarrow 2Na^+ + SO_4^{2-} + H_2O + CO_2 \uparrow$
Сокращенное ионное уравнение: $CO_3^{2-} + 2H^+ \rightarrow H_2O + CO_2 \uparrow$
Ответ:
$Na_2O + H_2O \rightarrow 2NaOH$
$NaOH + CO_2 \rightarrow NaHCO_3$
$NaHCO_3 + NaOH \rightarrow Na_2CO_3 + H_2O$
$Na_2CO_3 + H_2SO_4 \rightarrow Na_2SO_4 + H_2O + CO_2 \uparrow$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 5 расположенного на странице 48 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №5 (с. 48), авторов: Габриелян (Олег Саргисович), Остроумов (Игорь Геннадьевич), Сладков (Сергей Анатольевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















