Практическая работа №1, страница 52 - гдз по химии 9 класс учебник Габриелян, Остроумов

Авторы: Габриелян О. С., Остроумов И. Г., Сладков С. А.
Тип: Учебник
Издательство: Просвещение
Год издания: 2023 - 2025
Уровень обучения: базовый
Цвет обложки: белый, синий
ISBN: 978-5-09-110655-8
Допущено Министерством просвещения Российской Федерации
Популярные ГДЗ в 9 классе
Глава II. Химические реакции в растворах. §9. Гидролиз солей. Практическая работа - страница 52.
Практическая работа №1 (с. 52)
Условие. Практическая работа №1 (с. 52)
скриншот условия

Практическая работа 1
РЕШЕНИЕ ЭКСПЕРИМЕНТАЛЬНЫХ ЗАДАЧ ПО ТЕМЕ «ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ»
Вариант 1
1. Докажите опытным путём состав:
а) серной кислоты;
б) хлорида железа(III).
2. Испытайте растворы хлорида калия, карбоната калия и хлорида цинка раствором индикатора или индикаторной бумагой и объясните результаты испытаний. Запишите молекулярные и ионные уравнения реакций гидролиза.
3. Практически осуществите следующие превращения:
$CuSO_4 \rightarrow Cu(OH)_2 \rightarrow CuO \rightarrow CuCl_2 \rightarrow Cu$
Оформите отчёт о наблюдениях и условиях проведения реакций. Запишите уравнения реакций с участием электролитов в молекулярной и ионной формах. Реакции с участием простых веществ рассмотрите как окислительно-восстановительные.
Вариант 2
1. Докажите опытным путём состав:
а) гидроксида кальция;
б) сульфата аммония.
2. Испытайте растворы нитрата натрия, карбоната натрия и нитрата цинка раствором индикатора или индикаторной бумагой и объясните результаты испытаний. Запишите молекулярные и ионные уравнения реакций гидролиза.
3. Практически осуществите следующие превращения:
$Fe \rightarrow FeSO_4 \rightarrow Fe(OH)_2 \rightarrow FeCl_2 \rightarrow Fe(NO_3)_2$
Оформите отчёт о наблюдениях и условиях проведения реакций. Запишите их уравнения для реакций с участием электролитов в молекулярной и ионной формах. Реакции с участием простых веществ рассмотрите как окислительно-восстановительные.
Решение. Практическая работа №1 (с. 52)



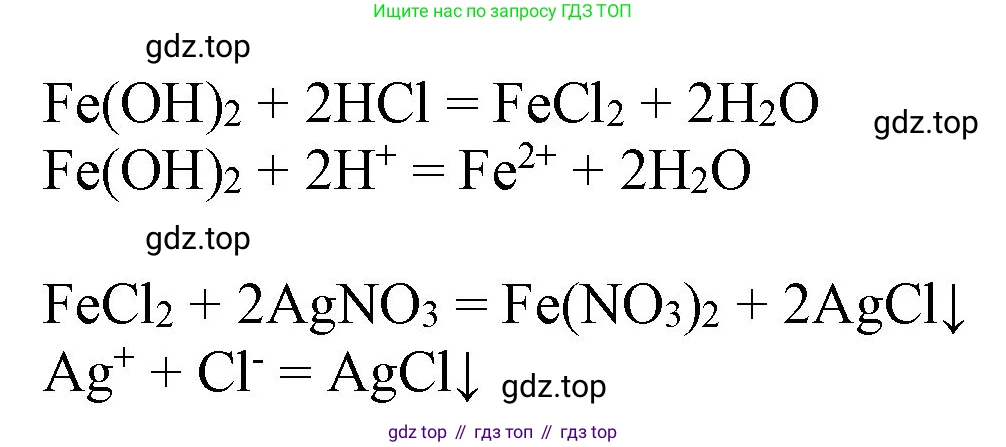
Решение 2. Практическая работа №1 (с. 52)
1. Докажите опытным путём состав:
а) серной кислоты;
Состав серной кислоты ($H_2SO_4$) доказывается проведением качественных реакций на ионы водорода ($H^+$) и сульфат-ионы ($SO_4^{2-}$), из которых она состоит.
1. Обнаружение ионов водорода ($H^+$). В пробирку с раствором серной кислоты добавляем несколько капель индикатора лакмуса или опускаем универсальную индикаторную бумагу.
Наблюдение:Лакмус приобретает красную окраску, что свидетельствует о кислой среде, создаваемой ионами водорода.
2. Обнаружение сульфат-ионов ($SO_4^{2-}$). В другую пробирку с раствором серной кислоты добавляем раствор хлорида бария ($BaCl_2$).
Наблюдение:Выпадает белый мелкокристаллический осадок сульфата бария ($BaSO_4$), который не растворяется при добавлении кислот.
Уравнения реакции:
- Молекулярное: $H_2SO_4 + BaCl_2 \rightarrow BaSO_4 \downarrow + 2HCl$
- Полное ионное: $2H^+ + SO_4^{2-} + Ba^{2+} + 2Cl^- \rightarrow BaSO_4 \downarrow + 2H^+ + 2Cl^-$
- Сокращенное ионное: $Ba^{2+} + SO_4^{2-} \rightarrow BaSO_4 \downarrow$
Ответ:Наличие в растворе ионов $H^+$ (доказано с помощью индикатора) и ионов $SO_4^{2-}$ (доказано реакцией с ионами $Ba^{2+}$) подтверждает, что исследуемое вещество является серной кислотой.
б) хлорида железа(III).
Состав хлорида железа(III) ($FeCl_3$) доказывается проведением качественных реакций на ионы железа(III) ($Fe^{3+}$) и хлорид-ионы ($Cl^-$).
1. Обнаружение ионов железа(III) ($Fe^{3+}$). В пробирку с раствором хлорида железа(III) добавляем раствор гидроксида натрия ($NaOH$).
Наблюдение:Образуется объёмный студенистый осадок бурого цвета – гидроксид железа(III) ($Fe(OH)_3$).
Уравнения реакции:
- Молекулярное: $FeCl_3 + 3NaOH \rightarrow Fe(OH)_3 \downarrow + 3NaCl$
- Полное ионное: $Fe^{3+} + 3Cl^- + 3Na^+ + 3OH^- \rightarrow Fe(OH)_3 \downarrow + 3Na^+ + 3Cl^-$
- Сокращенное ионное: $Fe^{3+} + 3OH^- \rightarrow Fe(OH)_3 \downarrow$
В качестве альтернативного реактива можно использовать тиоцианат калия ($KSCN$), который дает с ионами $Fe^{3+}$ характерное кроваво-красное окрашивание.
2. Обнаружение хлорид-ионов ($Cl^-$). В другую пробирку с раствором хлорида железа(III) добавляем раствор нитрата серебра ($AgNO_3$).
Наблюдение:Выпадает белый творожистый осадок хлорида серебра ($AgCl$), нерастворимый в азотной кислоте.
Уравнения реакции:
- Молекулярное: $FeCl_3 + 3AgNO_3 \rightarrow 3AgCl \downarrow + Fe(NO_3)_3$
- Полное ионное: $Fe^{3+} + 3Cl^- + 3Ag^+ + 3NO_3^- \rightarrow 3AgCl \downarrow + Fe^{3+} + 3NO_3^-$
- Сокращенное ионное: $Ag^+ + Cl^- \rightarrow AgCl \downarrow$
Ответ:Наличие в растворе ионов $Fe^{3+}$ (доказано реакцией со щёлочью) и ионов $Cl^-$ (доказано реакцией с ионами $Ag^+$) подтверждает, что исследуемое вещество является хлоридом железа(III).
2. Испытайте растворы хлорида калия, карбоната калия и хлорида цинка раствором индикатора или индикаторной бумагой и объясните результаты испытаний. Запишите молекулярные и ионные уравнения реакций гидролиза.
При испытании растворов солей индикатором наблюдается следующая картина:
- Хлорид калия ($KCl$): среда нейтральная (pH ≈ 7), окраска индикатора не изменяется. Соль образована сильным основанием ($KOH$) и сильной кислотой ($HCl$), поэтому гидролизу не подвергается.
Карбонат калия ($K_2CO_3$): среда щелочная (pH > 7), лакмус синеет, фенолфталеин становится малиновым. Соль образована сильным основанием ($KOH$) и слабой кислотой ($H_2CO_3$), поэтому гидролизуется по аниону:
Молекулярное уравнение: $K_2CO_3 + H_2O \rightleftharpoons KHCO_3 + KOH$
Ионное уравнение: $CO_3^{2-} + H_2O \rightleftharpoons HCO_3^- + OH^-$
Накопление гидроксид-ионов ($OH^-$) обусловливает щелочную среду раствора.
Хлорид цинка ($ZnCl_2$): среда кислая (pH < 7), лакмус розовеет. Соль образована слабым основанием ($Zn(OH)_2$) и сильной кислотой ($HCl$), поэтому гидролизуется по катиону:
Молекулярное уравнение: $ZnCl_2 + H_2O \rightleftharpoons Zn(OH)Cl + HCl$
Ионное уравнение: $Zn^{2+} + H_2O \rightleftharpoons ZnOH^+ + H^+$
Накопление ионов водорода ($H^+$) обусловливает кислую среду раствора.
Ответ:Среда раствора $KCl$ нейтральная, так как соль не гидролизуется. Среда раствора $K_2CO_3$ щелочная из-за гидролиза по аниону. Среда раствора $ZnCl_2$ кислая из-за гидролиза по катиону.
3. Практически осуществите следующие превращения: $CuSO_4 \rightarrow Cu(OH)_2 \rightarrow CuO \rightarrow CuCl_2 \rightarrow Cu$.
1. $CuSO_4 \rightarrow Cu(OH)_2$
Условия и наблюдения:К раствору сульфата меди(II) голубого цвета приливаем раствор щёлочи (например, $NaOH$). Выпадает голубой студенистый осадок гидроксида меди(II).
Уравнения:
Молекулярное: $CuSO_4 + 2NaOH \rightarrow Cu(OH)_2 \downarrow + Na_2SO_4$
Сокращенное ионное: $Cu^{2+} + 2OH^- \rightarrow Cu(OH)_2 \downarrow$
2. $Cu(OH)_2 \rightarrow CuO$
Условия и наблюдения:Пробирку с полученным осадком $Cu(OH)_2$ осторожно нагреваем. Голубой осадок чернеет в результате разложения и образования оксида меди(II).
Уравнение:
Молекулярное: $Cu(OH)_2 \xrightarrow{t} CuO + H_2O$
3. $CuO \rightarrow CuCl_2$
Условия и наблюдения:К полученному чёрному осадку $CuO$ приливаем соляную кислоту ($HCl$). Осадок растворяется, образуя раствор зелёного цвета - хлорид меди(II).
Уравнения:
Молекулярное: $CuO + 2HCl \rightarrow CuCl_2 + H_2O$
Сокращенное ионное: $CuO + 2H^+ \rightarrow Cu^{2+} + H_2O$
4. $CuCl_2 \rightarrow Cu$
Условия и наблюдения:В раствор хлорида меди(II) опускаем гранулу цинка ($Zn$). На поверхности цинка появляется красно-коричневый налёт металлической меди, а зелёная окраска раствора постепенно исчезает.
Уравнения (окислительно-восстановительная реакция):
Молекулярное: $CuCl_2 + Zn \rightarrow ZnCl_2 + Cu \downarrow$
Сокращенное ионное: $Cu^{2+} + Zn^0 \rightarrow Zn^{2+} + Cu^0$
Процессы:
$Cu^{2+} + 2e^- \rightarrow Cu^0$ (восстановление, $Cu^{2+}$ - окислитель)
$Zn^0 - 2e^- \rightarrow Zn^{2+}$ (окисление, $Zn$ - восстановитель)
Ответ:Цепочка превращений успешно осуществлена путем последовательного проведения реакций ионного обмена ($CuSO_4 \rightarrow Cu(OH)_2$, $CuO \rightarrow CuCl_2$), термического разложения ($Cu(OH)_2 \rightarrow CuO$) и окислительно-восстановительной реакции замещения ($CuCl_2 \rightarrow Cu$).
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения Практическая работа №1 расположенного на странице 52 к учебнику 2023 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению Практическая работа №1 (с. 52), авторов: Габриелян (Олег Саргисович), Остроумов (Игорь Геннадьевич), Сладков (Сергей Анатольевич), ФГОС (новый, красный) базовый уровень обучения учебного пособия издательства Просвещение.















