Номер 6, страница 13 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
2. Задачи на примеси и практический выход реакции. Упражнения и задачи для самостоятельного решения - номер 6, страница 13.
№6 (с. 13)
Условие. №6 (с. 13)
скриншот условия

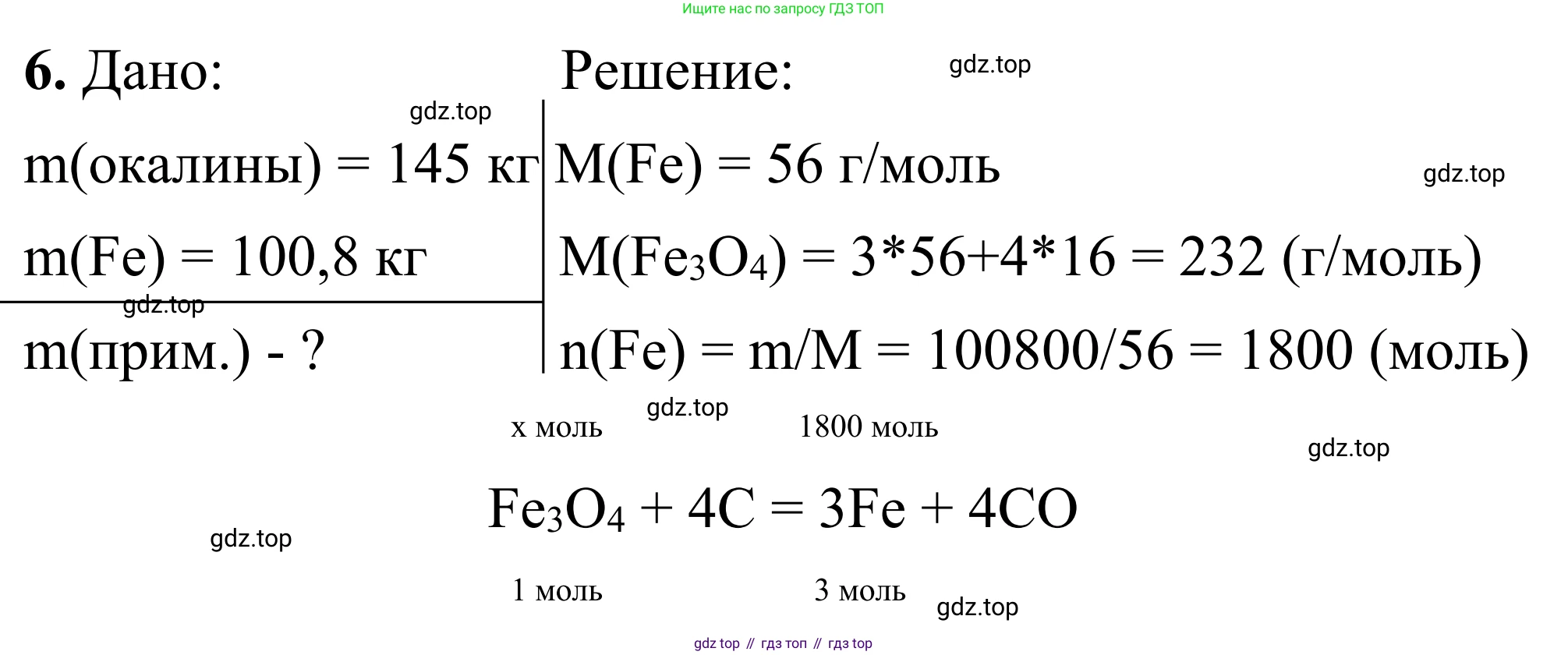
6. При восстановлении железной окалины массой 145 кг избытком углерода получили 100,8 кг чистого металла. Определите массу примесей в исходном образце железной окалины.
Решение. №6 (с. 13)

Решение 2. №6 (с. 13)
Дано:
Масса образца железной окалины: $m(обр.) = 145$ кг
Масса полученного чистого металла (железа): $m(Fe) = 100,8$ кг
Найти:
Массу примесей в исходном образце: $m(примесей) - ?$
Решение:
1. Железная окалина представляет собой в основном оксид железа(II,III) с формулой $Fe_3O_4$. Процесс восстановления железа из окалины избытком углерода описывается следующим химическим уравнением:
$Fe_3O_4 + 4C \rightarrow 3Fe + 4CO$
2. Рассчитаем молярные массы железа ($Fe$) и железной окалины ($Fe_3O_4$). Для удобства будем вести расчеты в килограммах (кг) и киломолях (кмоль).
Молярная масса железа $M(Fe) = 56$ кг/кмоль.
Молярная масса железной окалины $M(Fe_3O_4) = 3 \cdot 56 + 4 \cdot 16 = 168 + 64 = 232$ кг/кмоль.
3. Найдем количество вещества (в киломолях) чистого железа, полученного в ходе реакции:
$\nu(Fe) = \frac{m(Fe)}{M(Fe)} = \frac{100,8 \text{ кг}}{56 \text{ кг/кмоль}} = 1,8$ кмоль
4. По уравнению реакции определим, какое количество вещества $Fe_3O_4$ потребовалось для получения 1,8 кмоль железа. Согласно стехиометрическим коэффициентам, соотношение количеств вещества $\nu(Fe_3O_4) : \nu(Fe)$ равно $1 : 3$.
$\nu(Fe_3O_4) = \frac{1}{3} \cdot \nu(Fe) = \frac{1}{3} \cdot 1,8 \text{ кмоль} = 0,6$ кмоль
5. Теперь вычислим массу чистой железной окалины, которая содержалась в исходном образце и прореагировала с углеродом:
$m(Fe_3O_4) = \nu(Fe_3O_4) \cdot M(Fe_3O_4) = 0,6 \text{ кмоль} \cdot 232 \text{ кг/кмоль} = 139,2$ кг
6. Исходный образец массой 145 кг состоял из чистой железной окалины и негорючих примесей. Чтобы найти массу примесей, нужно из общей массы образца вычесть массу прореагировавшей чистой окалины:
$m(примесей) = m(обр.) - m(Fe_3O_4)$
$m(примесей) = 145 \text{ кг} - 139,2 \text{ кг} = 5,8$ кг
Ответ: масса примесей в исходном образце железной окалины составляет 5,8 кг.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 6 расположенного на странице 13 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №6 (с. 13), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















