Номер 36, страница 43 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
5. Теория электролитической диссоциации. Реакции ионного обмена. Упражнения и задачи для самостоятельного решения - номер 36, страница 43.
№36 (с. 43)
Условие. №36 (с. 43)
скриншот условия

36. Составьте уравнения реакций в молекулярной, полной и сокращённой ионной форме.
а) $NaOH\text{(изб.)} + H_2S \to$
б) $NaOH + H_2S\text{(изб.)} \to$
в) $Ca(OH)_2\text{(изб.)} + CO_2 \to$
г) $CaCO_3 + CO_2 + H_2O \to$
Решение. №36 (с. 43)

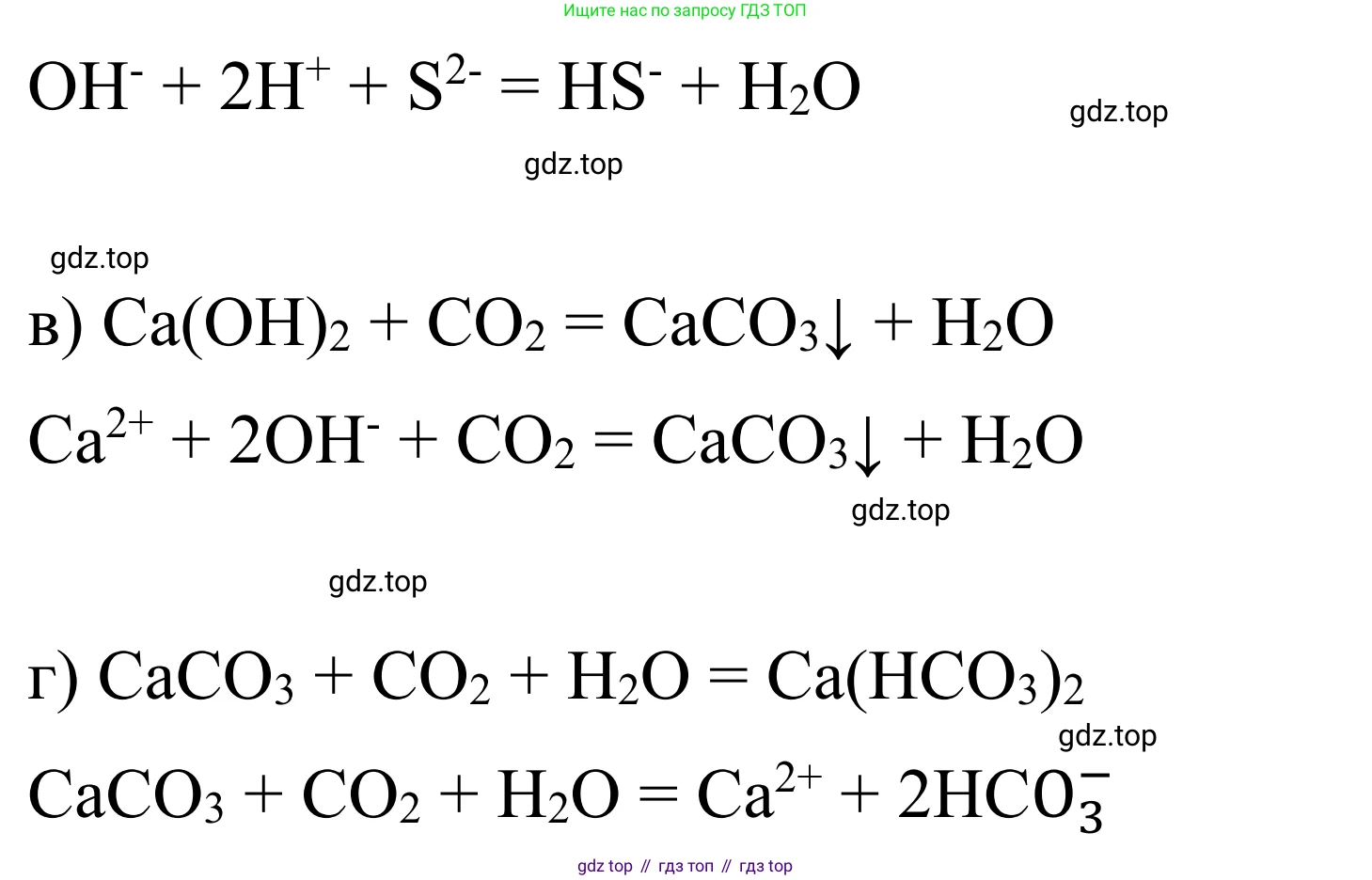
Решение 2. №36 (с. 43)
а) NaOH(изб.) + H₂S →
Решение:
При взаимодействии избытка сильного основания (гидроксида натрия) со слабой двухосновной сероводородной кислотой образуется средняя соль (сульфид натрия) и вода. Для написания ионных уравнений следует учесть, что гидроксид натрия и сульфид натрия являются сильными электролитами и диссоциируют на ионы, а сероводородная кислота и вода — слабые электролиты, поэтому записываются в молекулярной форме.
Молекулярное уравнение:
$2NaOH + H_2S \rightarrow Na_2S + 2H_2O$
Полное ионное уравнение:
$2Na^+ + 2OH^- + H_2S \rightarrow 2Na^+ + S^{2-} + 2H_2O$
Сокращенное ионное уравнение (получается после сокращения ионов-наблюдателей $Na^+$):
$2OH^- + H_2S \rightarrow S^{2-} + 2H_2O$
Ответ:
Молекулярное уравнение: $2NaOH + H_2S \rightarrow Na_2S + 2H_2O$
Полное ионное уравнение: $2Na^+ + 2OH^- + H_2S \rightarrow 2Na^+ + S^{2-} + 2H_2O$
Сокращенное ионное уравнение: $2OH^- + H_2S \rightarrow S^{2-} + 2H_2O$
б) NaOH + H₂S(изб.) →
Решение:
Если в реакцию с сильным основанием (гидроксидом натрия) вступает избыток слабой двухосновной кислоты (сероводородной), то образуется кислая соль (гидросульфид натрия) и вода. Гидроксид натрия и гидросульфид натрия — сильные электролиты, а сероводород и вода — слабые.
Молекулярное уравнение:
$NaOH + H_2S \rightarrow NaHS + H_2O$
Полное ионное уравнение:
$Na^+ + OH^- + H_2S \rightarrow Na^+ + HS^- + H_2O$
Сокращенное ионное уравнение (получается после сокращения ионов-наблюдателей $Na^+$):
$OH^- + H_2S \rightarrow HS^- + H_2O$
Ответ:
Молекулярное уравнение: $NaOH + H_2S \rightarrow NaHS + H_2O$
Полное ионное уравнение: $Na^+ + OH^- + H_2S \rightarrow Na^+ + HS^- + H_2O$
Сокращенное ионное уравнение: $OH^- + H_2S \rightarrow HS^- + H_2O$
в) Ca(OH)₂(изб.) + CO₂ →
Решение:
Взаимодействие избытка гидроксида кальция (сильное основание, известковая вода) с оксидом углерода(IV) (кислотный оксид) приводит к образованию нерастворимой средней соли — карбоната кальция (выпадает в осадок) — и воды. В ионных уравнениях нерастворимые вещества, газы и слабые электролиты записываются в молекулярной форме.
Молекулярное уравнение:
$Ca(OH)_2 + CO_2 \rightarrow CaCO_3 \downarrow + H_2O$
Полное ионное уравнение:
$Ca^{2+} + 2OH^- + CO_2 \rightarrow CaCO_3 \downarrow + H_2O$
Сокращенное ионное уравнение (в данном случае совпадает с полным, так как нет ионов-наблюдателей):
$Ca^{2+} + 2OH^- + CO_2 \rightarrow CaCO_3 \downarrow + H_2O$
Ответ:
Молекулярное уравнение: $Ca(OH)_2 + CO_2 \rightarrow CaCO_3 \downarrow + H_2O$
Полное ионное уравнение: $Ca^{2+} + 2OH^- + CO_2 \rightarrow CaCO_3 \downarrow + H_2O$
Сокращенное ионное уравнение: $Ca^{2+} + 2OH^- + CO_2 \rightarrow CaCO_3 \downarrow + H_2O$
г) CaCO₃ + CO₂ + H₂O →
Решение:
Эта реакция описывает растворение нерастворимого карбоната кальция в воде, насыщенной углекислым газом. При этом образуется растворимая кислая соль — гидрокарбонат кальция. Карбонат кальция как нерастворимое вещество, а также углекислый газ и вода как слабые электролиты записываются в молекулярном виде. Гидрокарбонат кальция — растворимая соль, сильный электролит.
Молекулярное уравнение:
$CaCO_3 + CO_2 + H_2O \rightarrow Ca(HCO_3)_2$
Полное ионное уравнение:
$CaCO_3 + CO_2 + H_2O \rightarrow Ca^{2+} + 2HCO_3^-$
Сокращенное ионное уравнение (совпадает с полным, так как в левой части уравнения нет ионов):
$CaCO_3 + CO_2 + H_2O \rightarrow Ca^{2+} + 2HCO_3^-$
Ответ:
Молекулярное уравнение: $CaCO_3 + CO_2 + H_2O \rightarrow Ca(HCO_3)_2$
Полное ионное уравнение: $CaCO_3 + CO_2 + H_2O \rightarrow Ca^{2+} + 2HCO_3^-$
Сокращенное ионное уравнение: $CaCO_3 + CO_2 + H_2O \rightarrow Ca^{2+} + 2HCO_3^-$
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 36 расположенного на странице 43 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №36 (с. 43), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















