Номер 38, страница 43 - гдз по химии 9 класс сборник задач и упражнений Габриелян, Тригубчак

Авторы: Габриелян О. С., Тригубчак И. В.
Тип: Сборник задач и упражнений
Издательство: Просвещение
Год издания: 2020 - 2026
Цвет обложки: белый, зелёный с кристаллом
ISBN: 978-5-09-073711-1
Популярные ГДЗ в 9 классе
5. Теория электролитической диссоциации. Реакции ионного обмена. Упражнения и задачи для самостоятельного решения - номер 38, страница 43.
№38 (с. 43)
Условие. №38 (с. 43)
скриншот условия

38. Составьте по два молекулярных уравнения реакций, соответствующих сокращённому ионному уравнению.
а) $Ba^{2+} + SO_4^{2-} \rightarrow BaSO_4$
б) $H^{+} + OH^{-} \rightarrow H_2O$
в) $3Ag^{+} + PO_4^{3-} \rightarrow Ag_3PO_4$
г) $Fe^{3+} + 3OH^{-} \rightarrow Fe(OH)_3$
Решение. №38 (с. 43)
Решение 2. №38 (с. 43)
Для каждого сокращенного ионного уравнения необходимо подобрать такие исходные вещества (реагенты), которые являются растворимыми в воде и диссоциируют на ионы, участвующие в реакции. Продукты реакции, которые не являются ионами (осадок, газ или вода), остаются в молекулярном виде, а оставшиеся ионы (если они есть) образуют растворимое соединение.
а) $Ba^{2+} + SO_{4}^{2-} \rightarrow BaSO_4$Данному сокращенному ионному уравнению соответствует реакция ионного обмена между любой растворимой солью бария (например, хлоридом $BaCl_2$ или нитратом $Ba(NO_3)_2$) и любым растворимым сульфатом (например, сульфатом натрия $Na_2SO_4$ или серной кислотой $H_2SO_4$). В результате реакции образуется нерастворимый в воде осадок сульфата бария $BaSO_4$.
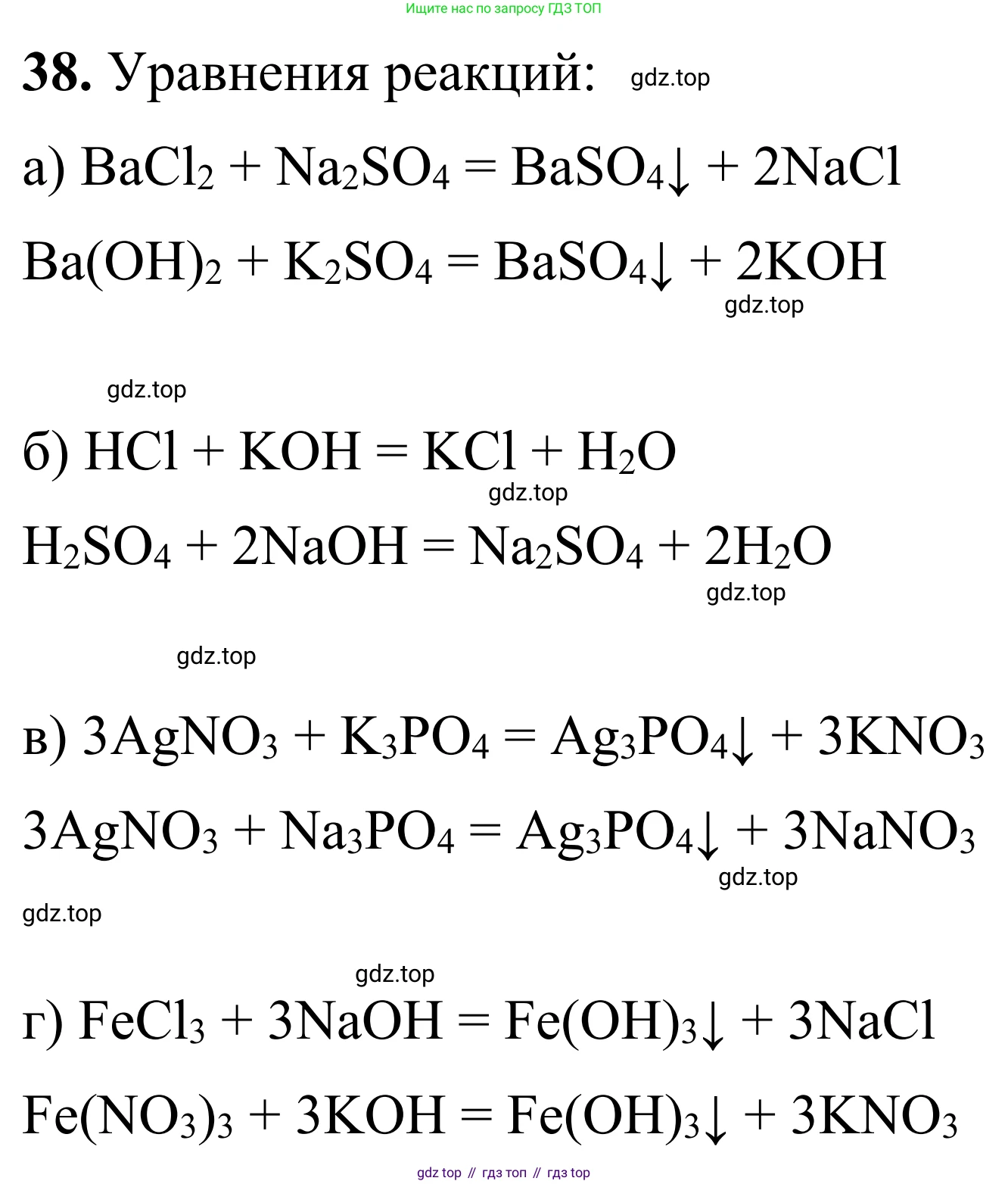
1. $BaCl_2 + Na_2SO_4 \rightarrow BaSO_4 \downarrow + 2NaCl$
2. $Ba(NO_3)_2 + K_2SO_4 \rightarrow BaSO_4 \downarrow + 2KNO_3$
Ответ: $BaCl_2 + Na_2SO_4 \rightarrow BaSO_4 \downarrow + 2NaCl$; $Ba(NO_3)_2 + K_2SO_4 \rightarrow BaSO_4 \downarrow + 2KNO_3$.
б) $H^{+} + OH^{-} \rightarrow H_2O$Это сокращенное ионное уравнение реакции нейтрализации. Ему соответствует взаимодействие любой сильной кислоты (источник ионов $H^+$) с любым сильным основанием (щелочью, источником ионов $OH^-$). Продуктом является вода — слабый электролит.
1. $HCl + NaOH \rightarrow NaCl + H_2O$
2. $H_2SO_4 + 2KOH \rightarrow K_2SO_4 + 2H_2O$
Ответ: $HCl + NaOH \rightarrow NaCl + H_2O$; $H_2SO_4 + 2KOH \rightarrow K_2SO_4 + 2H_2O$.
в) $3Ag^{+} + PO_{4}^{3-} \rightarrow Ag_3PO_4$Данному уравнению соответствует реакция между растворимой солью серебра (как правило, нитратом серебра $AgNO_3$) и растворимым фосфатом (например, фосфатом натрия $Na_3PO_4$ или калия $K_3PO_4$). В результате образуется нерастворимый осадок фосфата серебра $Ag_3PO_4$.
1. $3AgNO_3 + Na_3PO_4 \rightarrow Ag_3PO_4 \downarrow + 3NaNO_3$
2. $3AgNO_3 + K_3PO_4 \rightarrow Ag_3PO_4 \downarrow + 3KNO_3$
Ответ: $3AgNO_3 + Na_3PO_4 \rightarrow Ag_3PO_4 \downarrow + 3NaNO_3$; $3AgNO_3 + K_3PO_4 \rightarrow Ag_3PO_4 \downarrow + 3KNO_3$.
г) $Fe^{3+} + 3OH^{-} \rightarrow Fe(OH)_3$Это сокращенное ионное уравнение соответствует реакции осаждения гидроксида железа(III). Для этого нужно взять любую растворимую соль железа(III) (например, хлорид железа(III) $FeCl_3$ или сульфат железа(III) $Fe_2(SO_4)_3$) и любую щелочь (например, гидроксид натрия $NaOH$ или гидроксид калия $KOH$).
1. $FeCl_3 + 3NaOH \rightarrow Fe(OH)_3 \downarrow + 3NaCl$
2. $Fe_2(SO_4)_3 + 6KOH \rightarrow 2Fe(OH)_3 \downarrow + 3K_2SO_4$
Ответ: $FeCl_3 + 3NaOH \rightarrow Fe(OH)_3 \downarrow + 3NaCl$; $Fe_2(SO_4)_3 + 6KOH \rightarrow 2Fe(OH)_3 \downarrow + 3K_2SO_4$.
Другие задания:
Помогло решение? Оставьте отзыв в комментариях ниже.
Присоединяйтесь к Телеграм-группе @top_gdz
ПрисоединитьсяМы подготовили для вас ответ c подробным объяснением домашего задания по химии за 9 класс, для упражнения номер 38 расположенного на странице 43 к сборнику задач и упражнений 2020 года издания для учащихся школ и гимназий.
Теперь на нашем сайте ГДЗ.ТОП вы всегда легко и бесплатно найдёте условие с правильным ответом на вопрос «Как решить ДЗ» и «Как сделать» задание по химии к упражнению №38 (с. 43), авторов: Габриелян (Олег Саргисович), Тригубчак (Инесса Васильевна), ФГОС (старый) учебного пособия издательства Просвещение.















